Le Gallium a été prédit par Mendeleïev, qui l’avait appelé éka-aluminium. Il a été découvert en 1875 par le français Paul-Emile Lecoq de Boisbaudran. Son nom vient du latin Gallia signifiant Gaule, ou gallus, signifiant coq en référence à son propre nom.
Données physico-chimiques
Données atomiques
| Numéro atomique | Masse atomique | Configuration électronique | Structure cristalline | Rayon métallique pour la coordinence 12 |
| 31 | 69,72 g.mol-1 | [Ar] 3d10 4s2 4p1 | orthorhombique de paramètres a = 0,4519 nm, b = 0,7657 nm et c = 0,4526 nm | 141,1 pm |
Données physiques
| Masse volumique | Dureté | Température de fusion | Température d’ébullition | Conductibilité électrique | Conductibilité thermique | Solubilité dans l’eau |
|
1,5 | 29,78°C | 2 204°C | 6,78.106 S.m-1 | 40,6 W.m-1.K-1 | insoluble |
Données chimiques
| Électronégativité de Pauling | État d’oxydation le plus courant | pKa : Ga3+aq/GaOH2+aq | pKs : Ga(OH)3 |
| 1,81 | +3 | 3 | 35 |
Potentiels standards :
| Ga(OH)4– + 2e = Ga+ + 4OH– | E° < -1,24 V |
| Ga(OH)4– + 3e = Ga(s) + 4OH– | E° = 1,3 V |
| Ga3+ + 3e = Ga(s) | E° = -0,56 V |
| Ga3+ + 2e = Ga+ | E° < -0,40 V |
| Ga+ + e = Ga(s) (acide) | E° = -0,79 V |
| Ga+ + e = Ga(s) (basique) | E° = -1,39 V |
Données thermodynamiques
Gallium cristallisé :
|
Gallium liquide :
Gallium gazeux :
|
Données industrielles
L’existence du gallium a été prédite, en 1871, par Mendeleïev lors de la construction de son tableau périodique et d’après sa position il l’a appelé « eka-aluminium ».
Le chimiste français Lecoq de Boisbaudran l’a découvert, en 1875, par spectroscopie, dans un minerai de sphalérite (sulfure de zinc) puis extrait par électrolyse. Il l’a dénommé gallium d’après Gallia le nom latin de la Gaule.
Sa température de fusion étant de 29°C et celle d’ébullition de 2204°C, son utilisation principale a été, pendant longtemps, dans des thermomètres pour mesurer les températures élevées, avant, dans les années 1970, le développement de la microélectronique.
Matières premières
La teneur de l’écorce terrestre est de 19 ppm.
Il n’existe pas de gisements propres de gallium, celui-ci est co-produit, principalement, à 95 %, lors du traitement de la bauxite destinée à élaborer l’alumine puis l’aluminium. Le gallium peut également être co-produit, pour 5 % de la production, lors du traitement de minerais de zinc. Il est également présent dans des phosphates et des charbons mais ces sources ne sont pas actuellement exploitées.
La teneur en gallium des bauxites est comprise entre 30 et 80 ppm, les plus riches étant celles du Surinam. Très peu d’installations de traitement de la bauxite récupèrent le gallium. On estime que seulement 1 % du gallium contenu dans la bauxite exploitée est récupéré.
Fabrication industrielle
À partir du procédé Bayer de traitement de la bauxite.
Ce procédé, qui consiste à extraire l’alumine de la bauxite, en éliminant les impuretés présentes dans le minerai, utilise le caractère amphotère des hydroxydes d’aluminium et de gallium qui sont solubles en milieu basique ce qui n’est pas le cas, par exemple, des oxydes de fer (voir le chapitre aluminium).
La bauxite est traitée par une solution de NaOH concentrée et chaude. L’attaque, qui dure 2 jours, a lieu dans des autoclaves à 140°C pour les minerais de gibbsite et entre 200 et 280°C pour des minerais de böhmite et sous 2 à 4 MPa. On sépare ainsi l’aluminium et le gallium, en solution sous forme d’ions aluminates et gallates hydratés – (Al(OH)4(H2O)2)– et (Ga(OH)4(H2O)2)– – des oxydes de fer et de la silice, solides, qui donnent des « boues rouges ». Ensuite, Al(OH)3 précipite par dilution et refroidissement. La précipitation est initiée et contrôlée par une quantité importante d’amorce de Al(OH)3 provenant de fabrications précédentes. La concentration en ions gallates n’est pas suffisante pour que l’hydroxyde de gallium précipite.
Lors de la précipitation de l’alumine, la soude est régénérée puis la solution est recyclée avec les ions gallates contenus. Au cours de ces recyclages successifs, la concentration en ions gallates augmente jusqu’à atteindre de 100 à 300 mg/L. Différents procédés sont employés pour extraire le gallium :
- par solvant,
- par échange d’ions,
- par électrolyse sur cathode de mercure : dans ce cas, le gallium forme un amalgame avec le mercure, alors que les ions aluminium ne peuvent être réduits. La décomposition de l’amalgame, en milieu alcalin, redonne des ions gallates qui sont à nouveau réduits par électrolyse sur une cathode en acier inoxydable.
On obtient ainsi du gallium à 99 %.
Le gallium qui est principalement destiné à des applications électroniques nécessite une purification poussée afin d’obtenir une pureté de 99,9999 à 99,999999 % et des concentrations en plomb, mercure ou zinc, inférieures à 5 ppb. Une première purification consiste à opérer par filtration, sous vide, du gallium liquide, et lavage à l’aide d’acide chlorhydrique. On obtient alors une pureté de 99,99 %. La pureté électronique est obtenue par cristallisations fractionnées du gallium liquide ou par raffinage électrolytique du trichlorure de gallium.
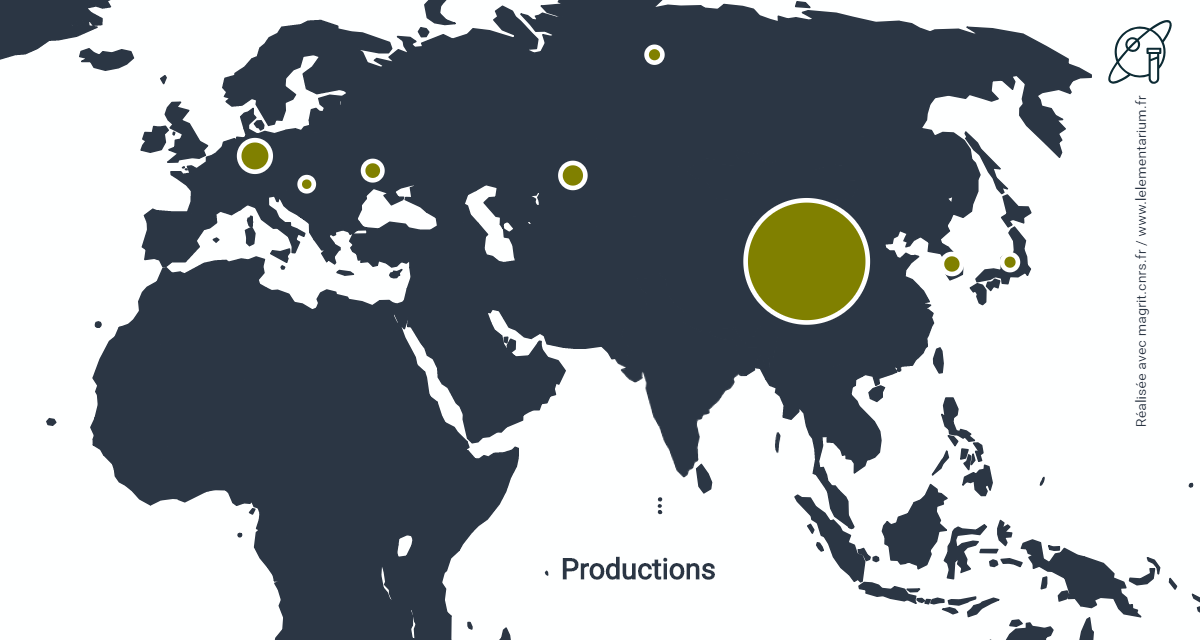
Productions
Production de gallium primaire (à 99,99 %), en 2019. Monde : 320 t.
| Chine | 310 | Japon | 3 | |
| Russie | 4 | Corée du Sud | 3 | |
| Ukraine | 4 |
Source : USGS
En 2019, la capacité mondiale de production de gallium à 99,99 % est de 720 t/an.
La production de gallium raffiné est de 205 t, pour une capacité de production de 330 t/an, située en Chine, au Japon, aux États-Unis et en Slovaquie.
Réserves : elles sont estimées, dans la bauxite, à plus d’un million de t.
Producteurs :
- Le groupe chinois Zhuhai SEZ Fangyan est le principal producteur mondial de gallium primaire avec une capacité de production de 140 t/an sur 6 sites.
- Le groupe chinois Chalco a produit, en 2018, 136 t de gallium sur 4 sites. Cette activité a été reprise par China Rare Earth, autre filiale du groupe Chinalco.
- 5N Plus (Canada), raffine et recycle du gallium en Corée du Sud, la production réalisée au Royaume Uni, à Wellingborough, avec une capacité de 20 t/an a été transférée, en 2017, dans d’autres usines du groupe.
- Neo Performance Materials produit du chlorure de gallium à Quapaw, aux États-Unis, dans l’Oklahoma avec 97 t/an et à Hyeongok, en Corée du Sud avec 105 t/an. Produit également du gallium secondaire aux États-Unis, à Blanding dans l’Utah, avec une capacité de 50 t/an et au Canada, à Peterborough, dans l’Ontario, avec une capacité de 15 t/an. C’est le 1er producteur mondial de chlorure de gallium employé dans la fabrication des LED.
- PPM Pure Metals, filiale du groupe Recylex, recycle et raffine du gallium à Langelsheim, en Allemagne, avec une production de 10 t/an.
- Dowa, produit, au Japon, du gallium primaire, à Akita, à partir du raffinage du zinc et raffine du gallium.
- Rusal, produit du gallium primaire à Nikolaev, en Ukraine.
- CMK, à Zarnovica, en Slovaquie, raffine et recycle du gallium.
Recyclage
De nombreuses utilisations étant sous forme de couches minces sur des substrats par dépôt chimique en phase vapeur ou par épitaxie par jets moléculaires, ces techniques se traduisent par des quantités importantes de dépôt sur les parois des chambres de préparation.
Ces dépôt sont dissous dans de l’acide nitrique à 2 moles/L puis du trichlorure de gallium est obtenu en présence d’acide chlorhydrique.
En 2019, la capacité mondiale de recyclage est de 270 t/an, située au Canada, en Chine, en Allemagne, au Japon, en Slovaquie et aux États-Unis.
Situation française
Production : actuellement il n’y a plus de production.
Rhône-Poulenc, en 1989-90 et 1996-97, a produit du chlorure de gallium à partir des solutions de traitement de la bauxite exploitée par Alcoa dans sa raffinerie de Pinjarra, en Australie. Cette production qui était la plus importante au monde avec 50 t/an a été suspendue en 1997. Le chlorure de gallium était exporté, en partie en France, à Salindres (30) pour produire 18 t/an de gallium raffiné. L’activité de Salindres a été reprise, en 1999, par la société GEO Gallium, qui a raffiné du gallium jusqu’en 2006, à partir de gallium primaire provenant de Stade, en Allemagne.
Du gallium primaire a été récupéré, jusqu’en 2003, à Noyelles-Godault (62), par Metaleurop, à partir de minerais de zinc.
Commerce extérieur : en 2019.
Les exportations étaient de 244 kg avec comme principaux marché à :
- 33 % la Lituanie,
- 13 % la Pologne,
- 6 % l’Espagne.
Les importations s’élevaient à 345 kg en provenance principalement à :
- 72 % d’Allemagne,
- 17 % des États-Unis,
- 7 % de Chine.
Utilisations
Elles sont principalement effectuées sous forme de gallium raffiné.
Consommation annuelle : dans le monde, en 2015, elle est estimée à 320 t dont 40 à 45 % provient du recyclage.
Au Japon, en 2017, la production de gallium raffiné est de 165 t provenant à 57 % d’importations de gallium primaire à 99,99 %, 41 % du recyclage et 2 % d’une raffinerie de zinc. Les importations proviennent à 69 % de Chine. La consommation de gallium raffiné est de 151 t.
Au États-Unis, en 2019, la consommation est de 15 t, à 75 % sous forme de GaAs et GaN et 25 % sous forme de triméthyl et triéthylgallium destinés à la fabrication de LED. Dans ce pays, les importations sont de 3 t hors importation de wafers de GaAs qui ont porté sur 340 t.
Secteurs d’utilisation : en 2014, plus de 90 % des utilisations concernent les semi-conducteurs sous forme principalement, à 80 %, d’arséniure de gallium, GaAs, à 7 % de nitrure de gallium, GaN et 5 % de séléniure de cuivre, indium et gallium (CIGS).
En 2019, aux États-Unis, 73 % des utilisations sont destinées aux circuits intégrés, 25 % à l’optoélectronique.
Dans les circuits intégrés, par rapport au silicium, l’arséniure de gallium présente l’avantage d’avoir une vitesse de circulation des électrons plus élevée et de résister aux radiations d’où son emploi dans des applications militaires.
La moitié des utilisations concerne les smartphones 3G et 4G.
Le nitrure de gallium est employé pour fabriquer des diodes électroluminescentes (LED) et est à la base de la lumière bleu, à 405 nm, des lasers employés dans les lecteurs Blu-ray. Ainsi la capacité de stockage sur DVD est passée de 4,7 à 25 Go. Le précurseur du GaN est principalement du triméthylgallium, avec, en 2015, une consommation mondiale de 61 t pour une capacité de production de 195 t/an, les principaux producteurs étant Nouryon et Dow. En 2016, 49 % de la production de LED est réalisé en Chine.
Le séléniure de cuivre, indium et gallium (CIGS), déposé en couches minces sur du verre ou des polymères, est employé pour élaborer des cellules solaires.
Bibliographie
- N. Foley et B. Jaskula, « Gallium – A smart metal« , Fact-Sheet 2013-3006, USGS Resources Program, mars 2013.
- P. Christmann, J-M. Angel, L. Bailly, F. Barthélémy, G. Benhamou, M. Billa, P. Gentilhomme, C. Hocquard, F. Maldan, B.Martel- Jantin, J. Monthel, Compagnie Européenne d’Intelligence Stratégique (CEIS) (2011), Panorama mondial 2010 du gallium, rapport final BRGM/RP- 60582- FR.
- « Le gallium« , Fiche de synthèse sur la criticité des métaux, BRGM, août 2016.
- B. Fameree, « Le Gallium, un métal rare, inépuisable grâce à sa production secondaire – Impacts et enjeux environnementaux et économiques de sa production jusqu’à sa récupération« , Université libre de Bruxelles, 2012.
- D. Huy, M. Liedtke, « Supply and demand of gallium« , Federal Institute for Geosciences and Natural Resources, Hanovre, mai 2016.