L’oxyde d’yttrium a été découvert en 1789 par John Gadoli. En 1804, Friedrich Wöhler isole le métal. Son nom vient d’Ytterby, village de l’île de Resarö dans l’archipel de Stockholm d’où vient la pierre dans laquelle il a été découvert. L’yttrium se trouve abondamment sur la lune.
Données physico-chimiques
Données atomiques
| Numéro atomique | Masse atomique | Configuration électronique | Structure cristalline |
Rayon métallique pour la coordinence 12 |
| 39 | 88,91 g.mol-1 | [Kr] 4d1 5s2 | hexagonale compacte de paramètres a = 0,3647 nm et c = 0,5731 nm | 180,1 pm |
Données physiques
| Masse volumique | Température de fusion | Température d’ébullition | Conductibilité électrique | Conductibilité thermique | Solubilité dans l’eau |
| 4,4689 g.cm-3 | 1 523°C | 3 337°C | 1,66.106 S.m-1 | 17,2 W.m-1.K-1 | légèrement décomposé |
Données chimiques
| Électronégativité de Pauling |
pKa : Yaq3+/YOHaq2+ |
E° : Y3+ + 3e = Y(s) |
||
| 1,22 | 9 | -2,37 V |
Données thermodynamiques
Yttrium cristallisé
|
Yttrium gazeux
|
Données industrielles
Voir le produit terres rares. Ne sont détaillées ici que quelques données particulières, des données plus complètes sont développées dans le produit terres rares.
Les terres rares représentent le groupe des lanthanides (éléments de numéros atomiques compris entre 57 et 71, du lanthane au lutécium) auquel on ajoute, du fait de propriétés chimiques voisines (même colonne de la classification périodique), l’yttrium (Y) et le scandium (Sc). On distingue les terres cériques, légères (lanthane, cérium, praséodyme, néodyme et samarium) des terres yttriques, plus lourdes (les autres terres rares).
Production
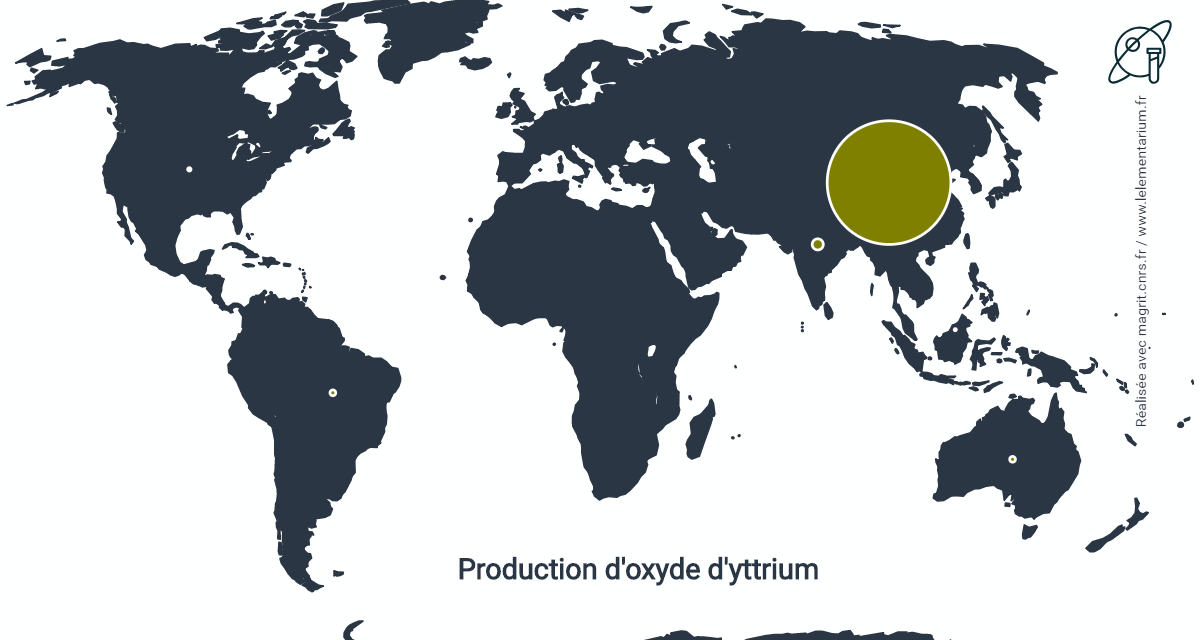
En 2013, la production d’oxyde d’yttrium, Y2O3, dans le monde s’élevait à 7 100 t d’oxyde produites dans les pays suivants :
| Chine | 7 000 t | Brésil | 15 t | |
| Inde | 56 t | États-Unis | 5 t | |
| Australie | 15 t | Malaisie | 2 t |
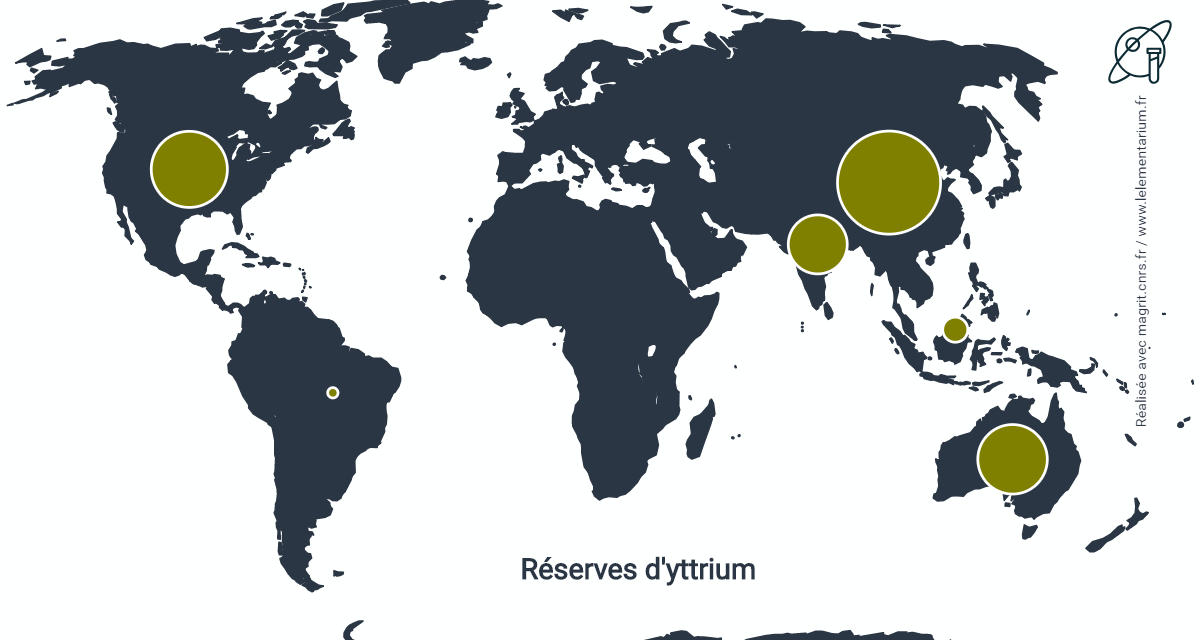
Réserves d’yttrium : en 2013, les réserves mondiales s’élevaient à 540 000 t exprimées en oxyde et se situaient dans les pays suivants :
| Chine | 220 000 t | Inde | 72 000 t | ||
| États-Unis | 120 000 t | Malaisie | 13 000 t | ||
| Australie | 100 000 t | Brésil | 2 200 t |
Procédé Rhône-Poulenc de séparation des terres rares
Solvay, utilise un procédé de séparation continu par extraction liquide-liquide à l’aide de solvants.
Le lanthane (à 99,995 % de pureté) est extrait, puis :
- le cérium (à 99,5 %), le didyme (alliage Nd-Pr séparé ensuite en Pr à 98 % et Nd à 95 %),
- le samarium/europium (séparé ensuite en Sm à 98 % et Eu à 99,99 %),
- le gadolinium/terbium (séparé ensuite en Gd à 99,99 % et Tb à 99,9 %),
- et l’ensemble des autres terres rares, l’yttrium étant obtenu, en fin d’extraction, à 99,99 %.
Lors des diverses extractions, réalisées en milieu nitrique, de nombreux types de solvants sont employés : acide di(2-ethylhexyl)phosphorique, tri(n-butyl)phosphate, sels d’ammonium quaternaire, acides carboxyliques… Dans l’usine de La Rochelle (17), plus de 1 100 étages de mélangeurs-décanteurs sont utilisés.
Les terres rares séparées sont livrées sous forme d’oxyde ou de sels, les puretés étant, en général, exprimées en masse par rapport aux autres terres rares, sans tenir compte des autres impuretés éventuellement présentes.
Les métaux et particulièrement le néodyme, l’yttrium et le terbium, sont préparés par calciothermie, à plus de 1 000°C, à partir du fluorure dans le cas du néodyme selon la réaction :
2NdF3 + 3 Ca = 2Nd + 3CaF2
Le samarium est préparé par réduction de l’oxyde par le lanthane ou le mischmétal, le métal, qui possède une tension de vapeur élevée, étant séparé par distillation sous vide.
Ces opérations métallurgiques sont réalisées principalement en Chine.
Utilisations
Les principales utilisations de l’yttrium sont :
- les luminophores : les sels d’yttrium qui n’ont pas de propriété de luminescence propre sont employés comme support des terres rares qui possèdent ces propriétés.
- la métallurgie : l’yttrium métal est employé pour améliorer la tenue aux chocs thermiques des aciers pour pipeline.
- les céramiques : l’oxyde d’yttrium, à des teneurs supérieures à 7 %, est utilisé pour stabiliser, à haute température, la forme cubique de la zircone (ZrO2). La zircone cubique, qui possède des propriétés de réfraction de la lumière proches de celles du diamant, est utilisée, comme imitation du diamant, en joaillerie.
Des sondes à oxygène, destinées à la mesure de la teneur en dioxygène des gaz émis par les moteurs à explosions afin d’ajuster celle-ci pour la combustion dans les pots catalytiques de CO et des hydrocarbures imbrûlés, sont en zircone plus ou moins dopée (de 1 à 10 % atomique) en oxyde d’yttrium. La stabilisation de la zircone par des ions trivalents à la place d’ions tétravalents entraîne la création de lacunes en oxygène qui confèrent au matériau une conductibilité ionique qui varie avec la pression partielle en dioxygène.
Bibliographie
- M. Seddon, « Analysing the changing global rare earths supply and demand outlook« , Argus Metal Pages Forum, Tokyo, 4 août 2016.
- B. Zhou, Z. Li, C. Chen, « Global potential of rare earth resources and rare earth demand from clean technologies », Minerals, 7, 203 , octobre 2017.
- C. He et Y. Lei, « Potential impact of U.S. re-emerging rare earths industry on future global supply and demand trend« , International Business Research, Vol. 6, N° 7, 2013.
- « Rare Earth Elements« , British Geological Survey, Novembre 2011.
- « Étude de faisabilité de la saisine sur les enjeux stratégiques des terres rares« , Office parlementaire d’évaluation des choix scientifiques et technologiques, Paris, 8 juillet 2014.
- The Association for Rare Earth (RARE), 1615L Street, NW 13th floor, Washington DC 20036, Etats-Unis.
- Long, K.R., Van Gosen, B.S., Foley, N.K., and Cordier, Daniel, « The principal rare earth elements deposits of the United States—A summary of domestic deposits and a global perspective« , U.S. Geological Survey Scientific Investigations Report 2010–5220, 96 p., 2010.
- K. Bru, P. Christmann, J.-F. Labbé, G. Lefebvre, « Panorama mondial 2014 du marché des terres rares« , Rapport BRGM/RP-64330-FR, novembre 2015.