L’abbé René Just Haüy ayant observé l’analogie géométrique des cristaux de béryl et d’émeraude, demanda à Louis Nicolas Vauquelin d’en réaliser l’analyse. En 1798 celui-ci montra la présence d’une « nouvelle terre », l’oxyde de béryllium qu’il dénomma glucinium, du grec douceur. Le métal, fut isolé, en 1828, indépendamment à Paris par Antoine Bussy et à Berlin par Friedrich Wöhler, ce dernier lui donnant le nom de béryllium.
Données physico-chimiques
Données atomiques
| Numéro atomique | Masse atomique | Configuration électronique | Structure cristalline | Rayon métallique pour la coordinence 12 |
| 4 | 9,012 g.mol-1 | [He] 2s2 | hexagonale de paramètres a = 0,2289 nm et c = 0,3583 nm | 113 pm |
Données physiques
| Masse volumique | Dureté | Température de fusion |
Température d’ébullition |
Conductibilité électrique |
Conductibilité thermique |
Solubilité dans l’eau froide |
Solubilité dans l’eau chaude |
| 1,848 g.cm-3 | 5,5 | 1 278°C | 2 970°C | 31,3.106 S.m-1 | 201 W.m-1.K-1 | insoluble | peu soluble |
Données chimiques
| Électronégativité de Pauling | État d’oxydation | pKa : Be(aq)2+/BeOH(aq)+ | E° : Be2+ + 2e = Be(s) |
pKs : Be(OH)2 |
| 1,57 | +2 | 6 | -1,85 V | 17,7 |
Données thermodynamiques
| Béryllium cristallisé | Béryllium gazeux |
|
|
Données industrielles
Matières premières
La teneur en béryllium (Be) de l’écorce terrestre est de 2,8 ppm.
Deux minéraux de béryllium sont exploités industriellement, la bertrandite (Be4Si2O7(OH)2) aux États-Unis et le béryl (Be3Al2Si6O18), dans des pegmatites granitiques, dans les autres pays. Aux États-Unis, la teneur du minerai de bertrandite exploité est de 0,25 % de Be.
Jusqu’en 1969, début de l’exploitation du gisement de bertrandite des États-Unis par Materion, seuls les gisements de béryl étaient exploités.
Les gisements de béryl sont également exploités pour leurs cristaux d’émeraude, d’aigue-marine… L’émeraude est un béryl, c’est-à-dire un silicoaluminate de béryllium dans lequel une partie des ions Al3+ est substituée par des ions Cr3+ ou V3+.
Productions
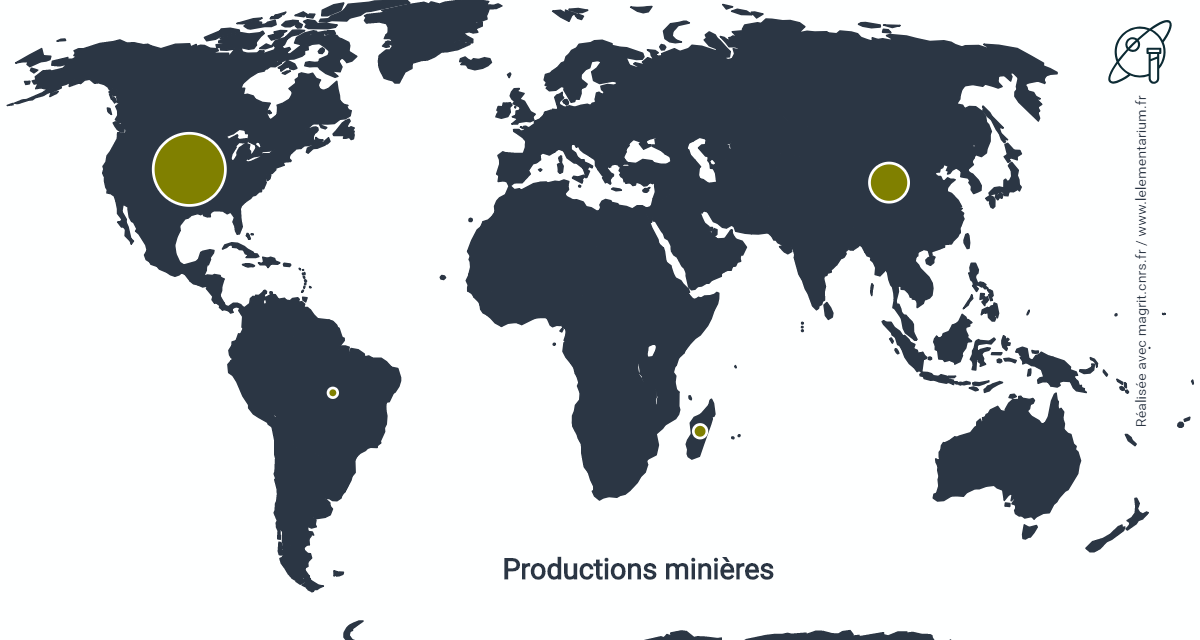
Productions minières
Elle est estimée, en 2019, à 260 t de béryllium contenu.
| États-Unis | 170 | Mozambique | 15 | |
| Chine | 70 | Brésil | 3 |
Source : USGS
En 2017, la production mondiale de concentrés de béryl, contenant environ 4 % de Be, est estimée à 1 540 t.
Réserves minières
Elles sont peu connues, sauf pour les États-Unis où elles sont évaluées à 20 000 t de Be contenu, en 2019.
Fabrication industrielle
Les minerais de béryl sont concentrés, ceux de bertrandite traités directement par hydrométallurgie.
Aux États-Unis, le minerai de bertrandite et les concentrés de béryl importés sont lixiviés, à chaud, par de l’acide sulfurique. Au préalable, les concentrés de béryl sont fondus à 1650°C trempés dans l’eau et traités à l’acide sulfurique. Seulement 50 à 60 % du Be contenu passant en solution, un deuxième traitement thermique de la pulpe inattaquée vers 900-1000°C, permet d’augmenter le taux de récupération du béryllium à 90-95 %.
La solution de lixiviation contient de 0,4 à 0,7 g de Be/L. Les métaux contenus sont extrait par un solvant organique et ré-extrait par une solution de carbonate d’ammonium, vers 70°C. Après élimination des ions fer et aluminium par précipitation sous forme d’hydroxydes, à 85°C, et filtration, un chauffage à 95°C, entraîne la précipitation du béryllium sous forme de carbonate basique, BeCO3,Be(OH)2 qui par chauffage est décomposé en hydroxyde de béryllium Be(OH)2, appelé glucine. L’oxyde de béryllium BeO, est obtenu par calcination de l’hydroxyde.
Le béryllium métallique, est préparé par électrolyse en sel fondu, en présence de chlorure de sodium, lithium ou potassium. Le béryllium obtenu titre 99,5 %. Sa purification est réalisée par anode soluble, dans un bain de chlorure fondu.
Principaux producteurs
Les principaux producteurs sont :
- Materion, qui exploite le gisement de bertrandite des États-Unis. Le gisement, à ciel ouvert, est situé à Spor Mountain, près de Delta, dans le comté de Juab, dans l’Utah. En 2019, la production a été de 163,7 t de béryllium contenu. Les réserves prouvées et probables sont, fin 2019, de 8,813 millions de t contenant 0,248 % de Be. Le minerai est traité à Delta, dans l’Utah pour produire de l’hydroxyde de béryllium, lui même transformé en alliages de cuivre, en métal et oxyde, à Elmore, dans l’Ohio. A Elmore, la capacité de production de métal de haute pureté est de 73 t/an dont les 2/3 sont destinées au département de la Défense des États-Unis. En 2018, tout l’hydroxyde produit est obtenu à partir de la bertrandite exploitée localement. Le béryllium de haute pureté est préparé plutôt à partir de béryl importé que de bertrandite produite localement car cette dernière renferme plus d’impuretés.
- Ulba Metallurgical Plant (UMP), filiale de KazAtomProm, qui produit, au Kazakhstan, divers composés de béryllium, des alliages et du métal, à partir des stocks accumulés, en Russie, avant 1990. En 2016, la production est de 90 t de Be contenu dans les composés fabriqués.
En Chine, en 2015, la production serait de 100 t dont 50 t à partir de minerais importés principalement du Kazakhstan. Les principaux producteurs chinois sont Hunan Shuikoushan Non Ferrous Metals Group dans la région autonome du Xinjiang et Fuyun Hengsheng Beryllium Industry dans la province du Guangdong.
Recyclage et stocks
Le recyclage est estimé de 20 à 25 % de la consommation.
Considéré, aux États-Unis comme un métal stratégique, en 2019, son stock est de 67 t de métal, 7 t de poudre et 1 t de concentré de béryl.
Situation française
Il n’y a plus de production minière. Une faible production de béryl a eu lieu au début du XXème siècle, dans les Monts d’Ambazac (87). La présence de béryllium, associé au lithium, est attestée dans quelques sites (voir le chapitre lithium).
Il n’y a plus de production métallurgique depuis 1976. Avant cette date, la société Péchiney avait développé, à Salindres (30) et La Praz (73), une filière complète de production de béryllium.
La mise en forme d’alliages de béryllium est réalisée, à Couëron (44) par le groupe japonais NGK Berylco.
Commerce extérieur : en 2019 pour le béryllium brut et la poudre.
- Exportations : 19 kg.
- Importations : 62 kg à 100 % des États-Unis.
Utilisations
Consommations
La consommation mondiale, en 2014, était estimée à environ 300 t, dont, en 2019, 180 t aux États-Unis.
En 2011, la consommation européenne était de 30,2 t dont 22,2 t en Allemagne.
Secteurs d’utilisation
Les principaux secteurs utilisateur de Be dans le monde, en 2009, sont :
| Télécom et information | 51 % | Électronique pour automobile | 13 % | |
| Défense et aérospatial | 16 % | Composants industriels | 12 % |
Source : Biz Acumen
Utilisations diverses
La principale utilisation, avec 75 % du total en 2017, est sous forme d’alliages de cuivre, renfermant de 0,15 à 2,6 % de Be. Ces alliages sont utilisés principalement dans des connections électroniques, les circuits intégrés et la fabrication de moules pour injection de matières plastiques. Les alliages Cu-Be sont préparés à partir d’un alliage-maître renfermant 4 % de Be. Après ajustement de la composition souhaitée, l’alliage en fusion est solidifié et maintenu vers 800°C. A cette température l’alliage est monophasé, avec dissolution du béryllium dans le cuivre, à 800°C la solubilité étant d’environ 2 %. Il est malléable et peut être mis en forme facilement. Une trempe permet de conserver un alliage malléable, avec une seule phase, mais avec une solution solide sursaturée car, à la température ambiante, la solubilité du Be dans le cuivre est très faible, inférieure à 0,25 %. Un durcissement structural est obtenu, par un chauffage de revenu, entre 300 et 400°C, qui permet d’accélérer l’obtention d’un état stable avec formation de deux phases, du cuivre renfermant très peu de béryllium et un précipité intermétallique du type CuBe.
Les autres utilisations sont les suivantes :
- Les alliages avec l’aluminium sont employés dans l’aéronautique et le spatial du fait de la faible densité du béryllium et de la dureté des alliages formés. Ces alliages sont également obtenus par durcissement structural.
- Les alliages avec le nickel sont employés dans des contacteurs thermo-sensibles utilisés, par exemple, dans le déclenchement des airbags.
- Des alliages nickel-chrome ou nickel-cobalt contenant du béryllium sont employés dans des prothèses dentaires. Mais dans cette application la teneur en béryllium est actuellement limitée à 0,02 %.
- Sa faible densité et son bon comportement au polissage le fait utiliser comme matériau de miroirs de télescopes spatiaux.
- Dans le domaine spatial, il est utilisé comme matériau de tuyères de moteurs, de gyroscopes…
- De faible numéro atomique, il absorbe peu le rayonnement X et pour cela est utilisé comme fenêtre de tubes de production de rayonnement X.
- Il est utilisé comme réflecteur de neutrons dans les ogives nucléaires et ralentisseur de neutrons dans les centrales nucléaires.
- Le béryllium est prévu comme matériau de couverture du plasma dans le réacteur ITER, en construction à Cadarache.
- L’oxyde de béryllium, BeO, isolant électrique, possède une conductibilité thermique élevée, juste après celle du diamant. Il trouve des applications comme support de composants électroniques. Ses propriétés réfractaires le font également utiliser comme matériau de boucliers de rentrée dans l’atmosphère de missiles. En 2017, il représente, dans le monde, 5 % de la consommation de béryllium.
Toxicité
Le béryllium est un métal très toxique et cancérigène. Des teneurs dans l’atmosphère supérieures à 100 µg/m3 peuvent causer des pneumopathies graves, une exposition chronique donnant une maladie professionnelle, la bérylliose. La valeur limite d’exposition est de 2 µg/m3.
Bibliographie
- P. Christmann , L. Corbineau , J.F. Labbé et J. Monthel, avec la collaboration extérieure de la Compagnie Européenne d’Intelligence Stratégique (CEIS) (2011) – Panorama mondial 2010 du marché du béryllium. BRGM/RP – 60203 – FR, 60 p., 15 fig., 7 tabl.
- BeST (Beryllium Science and Technology Association), rue Belliard 40, 1040 Bruxelles, Belgique.
- M.A. Boland, « Beryllium – Important for national defense« , Fact sheet, 2012-3056, USGS, mai 2012.
- C. Gayot, A. Renier, « Le cuivre béryllium : un alliage indispensable au quotidien« , Traitement & Matériaux, 454, novembre 2018.