Données physico-chimiques
Données atomiques
| Numéro atomique | Masse atomique | Configuration électronique | Structure cristalline | Rayon métallique pour la coordinence 12 |
| 55 | 132,9 g.mol-1 | [Xe] 6s1 | cubique centrée de paramètre a = 0,614 nm | 273,1 pm |
Données physiques
| Masse volumique | Dureté | Température de fusion | Température d’ébullition | Conductibilité électrique | Conductibilité thermique | Solubilité dans l’eau |
| 1,878 g.cm-3 | 0,2 | 28,40°C | 678,4°C | 4,89.106 S.m-1 | 35,9 W.m-1.K-1 | oxydé en Cs+ avec dégagement de dihydrogène |
Données chimiques
| Électronégativité de Pauling | État d’oxydation | E° : Cs+ + e = Cs(s) | E° : Cs+ + (Hg) + e = Cs(Hg) |
| 0,79 | +1 | -2,92 V | -1,78 V |
Données thermodynamiques
Césium cristallisé
|
Césium gazeux
|
Données industrielles
Matières premières
La teneur en césium (Cs) de l’écorce terrestre est de 3 ppm.
Le principal minéral renfermant du césium est un silicoaluminate, la pollucite, Cs2Al2Si4O12. Elle est présente dans des pegmatites, en association avec des minéraux de lithium (pétalite, LiAlSi4O10, spodumène, LiAlSi2O6, lépidolite, (K,Rb)(Li,Al)3(Si,Al)4O10(F,OH)2)…), de tantale, de rubidium…. La teneur des gisements varie de 5 à 32 % de Cs2O.
Le principal gisement mondial est celui de Bernic Lake, au Canada, dans la province du Manitoba. Il était exploité souterrainement à 60 m sous le niveau du lac, par la société Tantalum Mining Corporation (Tanco), filiale de Cabot qui a vendu, fin juin 2019, cette activité au groupe chinois Sinomine Resource. Le gisement s’étend sur 1 520 m de long, 1 060 m de large et sur une épaisseur de plus de 100 m.
La masse totale de pegmatite est de 57,4 millions de t renfermant :
Fin 2015, l’exploitation minière a été arrêtée, la production se poursuivant à partir des stocks accumulés.
En 2019, la société australienne Pioneer Resources a débuté l’exploitation à ciel ouvert de la mine de pollucite de Sinclair, en Australie de l’Ouest, à 130 km au sud de Kalgoorlie. Les ressources mesurées sont de 10 500 t renfermant 17,1 % de Cs2O.
Des exploitations fonctionnent également, avec une coproduction de césium lors de l’exploitation de mines de lithium, à Bikita, au Zimbabwe et dans le désert de Karibib, en Namibie.
Fabrication industrielle
La pollucite est dissoute à chaud soit dans de l’acide chlorhydrique en donnant du chlorure de césium qui est ensuite purifié soit dans l’acide sulfurique en donnant de l’alun, sulfate double d’aluminium et de césium. Ce dernier, chauffé en présence de charbon, donne du sulfate de césium soluble qui est généralement transformé en chlorure, forme commerciale la plus courante.
Le formiate de césium est obtenu par réaction de l’hydroxyde de césium avec l’acide formique.
Le césium métal est obtenu par réduction du chlorure de césium vers 700-800°C, à l’aide de calcium ou de baryum. Le césium volatil est récupéré.
Productions
La production mondiale est estimée à 5 à 10 t/an.
En 2014, la production canadienne de la mine de Bernic Lake était de 17 300 kg de pollucite qui ont donné 3 890 kg de césium puis 5 630 kg de formiate de césium.
Principal producteur
Le principal producteur était la société Tantalum Mining Corporation (Tanco), filiale de Cabot, qui exploitait la mine de Bernic Lake. Fin juin 2019, cette activité a été vendue au groupe chinois Sinomine Resources.
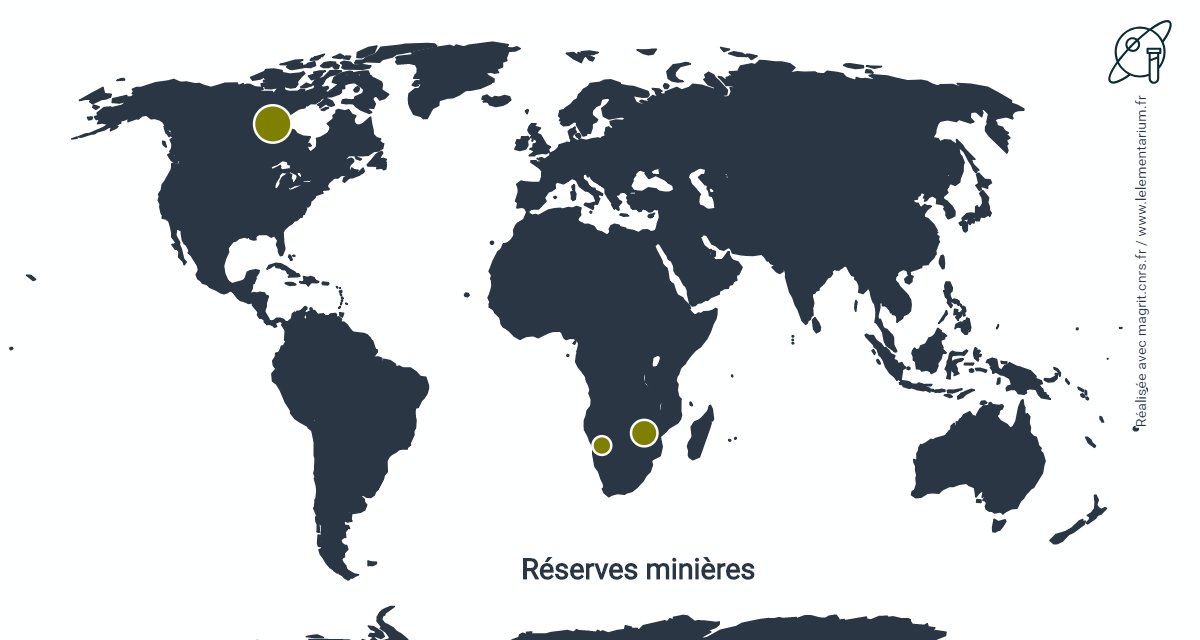
Réserves minières
Elles sont estimées à partir des réserves connues de pollucite. Les réserves mondiales ont été évaluées à 220 000 t de Cs2O, en 2019, réparties dans les pays suivants :
| Canada | 120 000 t | Namibie | 30 000 t | |
| Zimbabwe | 60 000 t | Australie | 7 100 |
Source : USGS
Recyclage
Le formiate de césium employé en forage pétrolier ou gazier est recyclé à 85 %.
Utilisations
Consommation
Elle est estimée, dans le monde à quelques tonnes par an.
Secteurs d’utilisation
La principale utilisation est sous forme de solution aqueuse de formiate de césium comme boue de forages pétroliers et gaziers. La formiate de césium, ou méthanoate de césium, CsHCOO, est particulièrement employé dans le cas de forages sous haute pression, jusqu’à 1 000 atmosphères et haute température, jusqu’à 200°C, par exemple en Mer du Nord. La densité de la solution saturée est de 2,3. Elle peut être ajustée à la valeur souhaitée par ajout de formiate de sodium ou de potassium.
Utilisations diverses
Elles sont les suivantes :
- En électronique, le césium est employé dans les cellules photoélectriques, dans des photomultiplicateurs d’électrons, des spectrophotomètres infrarouge, sous forme de cristaux d’halogénures de césium dans les compteurs de scintigraphie.
- Des solutions concentrées de chlorure de césium sont employées en centrifugation sur gradient de densité, appelée également centrifugation isopycnique, pour séparer divers ADN et les purifier en éliminant l’ARN et les protéines.
- Le nitrate de césium est employé en pyrotechnie pour donner la couleur indigo. Il est également utilisé en catalyse dans le craquage pétrolier.
- L’isotope 133Cs, le seul qui soit stable, est à la base de la définition de la seconde. En 1967, la 13ème Conférence générale sur les poids et mesures choisit de définir la seconde comme la durée de 9 192 631 770 périodes de la radiation correspondant à la transition entre les 2 niveaux hyperfins de l’état fondamental de l’atome de césium 133 au repos, à une température de 0 K.
- Des isotopes du césium sont issus de la fission de l’uranium et ont contaminé l’environnement lors d’essais atmosphériques et accidents nucléaires. Il s’agit de 134Cs avec 2 ans de période, 135Cs avec 2,3 millions d’années de période et 137Cs avec une période de 30,108 ans. Ces isotopes radioactifs, émetteurs gamma, sont particulièrement toxiques. L’isotope 135Cs, avec une très longue période, est l’un des isotopes posant des problèmes pour la gestion à long terme des déchets nucléaires.
Bibliographie
- W. C. Butterman, W.E. Brooks and R.G. Reese Jr., « Cesium« , Open-file report 2004-1432, Mineral Commodity Profiles, USGS, 2005.
- T. Martins, P. Kremer and P. Vanstone, « The Tanco mine : geological setting, internal zonation and mineralogy of a world-class rare element pegmatite deposit« , Field Trip Guidebook FT-C1, mai 2013.
- R.L. Linnen, M. van Lichtervelde, P. Cerny, « Granite pegmatite as sources of strategic metals« , Elements, vol 8, p 275-80, août 2012.