En 1782, le minéralogiste Franz-Joseph Müller von Reichenstein analyse des minerais d’or en Transylvanie persuadé de trouver de l’antimoine. Après plusieurs recherches il conclut que cet élément n’entre pas dans la composition du minerais mais qu’un autre élément encore inconnu est présent. C’est en 1798 que Martin Heinrich Klaproth isola cet élément et le nomma tellure d’après le latin tellus, déesse de la Terre.
Données physico-chimiques
Données atomiques
| Numéro atomique | Masse atomique | Configuration électronique | Structure cristalline | Rayon métallique pour la coordinence 12 |
| 52 | 127,6 g.mol-1 | [Kr] 4d10 5s2 5 p4 | hexagonale de paramètres a = 0,4456 nm et c= 0,5927 nm | 160 pm |
Données physiques
| Masse volumique | Dureté | Température de fusion | Température de sublimation | Conductibilité électrique | Conductibilité thermique | Solubilité dans l’eau |
| 6,25 g.cm-3 | 2,25 | 449,5°C | 989,8°C | 200 S.m-1 | 2,35 W.m-1.K-1 | insoluble |
Données chimiques
| Électronégativité de Pauling | pKa : H2Te/HTe– | pKa : HTe–/Te2- | pKa : H3TeO3+/H2TeO3 | pKa : H2TeO3/HTeO3– | pKa : HTeO3–/TeO32- | pKa : H6TeO6/H5TeO6– | pKa : H5TeO6–/H4TeO62- | pKs : Te(OH)4 |
| 2,1 | 2 | 11 | 2,5 à 3,5 | 3,2 à 5,8 | 7,7 | 7,7 | 11 | 57,7 |
Potentiels standards :
| Te(s) + 2e = Te2- | E° = -1,14 V |
| Te2(s) + 2e = Te22- | E° = -0,84 V |
| H6TeO6(s) + 2H+ + 2e = TeO2(s) + 4H2O | E° = 1,02 V |
| TeOOH+ + 3H+ + 4e = Te(s) + 2H2O | E° = 0,56 V |
| TeO2(s) + 4H+ + 4e = Te(s) + 2H2O | E° = 0,59 V |
| TeO32- + 3H2O + 4e = Te(s) + 6OH– | E° = -0,57 V |
Données thermodynamiques
Tellure cristallisé :
|
Tellure gazeux :
|
Données industrielles
Matières premières
La teneur de l’écorce terrestre en tellure est de 1 ppb, ce qui en fait un des éléments naturels le plus rare.
Il n’existe pas de gisement propre de tellure, celui-ci est, associé avec le sélénium, principalement co-produit de la métallurgie du cuivre mais aussi de celles du plomb et du nickel. Le tellure est présent dans des sulfures métalliques en substitution du soufre, sous forme de tellurures, dans lesquels le tellure possède le degré d’oxydation -2, analogues aux sulfures, ou dans les parties oxydées, sous forme de tellurites, dans lesquels le tellure possède le degré d’oxydation +4, analogues aux sulfites.
La métallurgie des minerais sulfurés de cuivre peut ainsi récupérer, en moyenne, 65 g de Te/t de cuivre.
Fabrication industrielle
Comme co-production de la métallurgie du cuivre (voir le chapitre cuivre).
Le tellure peut être récupéré lors du traitement, par pyrométallurgie, des minerais sulfurés de cuivre. Cela n’est pas le cas pour la voie hydrométallurgique.
Après le traitement pyrométallurgique des concentrés de cuivre, le tellure, avec le sélénium, se retrouve dans le blister, constitué, à 99 %, de cuivre. Celui-ci est purifié par électrolyse à anode soluble après avoir été coulé sous forme d’anodes et le cuivre, avec une pureté de 99,99 %, se dépose à la cathode. Lors de l’électrolyse, il se forme des boues qui renferment les impuretés, bismuth, or, argent, sélénium, tellure ainsi que de 15 à 35 % de cuivre. Celles-ci peuvent contenir de 5 à 25 % de sélénium, sous forme de séléniures et de 5 à 10 % de tellure sous forme de tellurures, de cuivre, d’argent et d’or.
La plupart des raffineries de cuivre récupère ces boues mais elles ne sont exploitées pour la récupération du tellure, du sélénium et des métaux précieux contenus que par une partie d’entre elles. Les autres les exportent vers les installations pratiquant cette récupération.
Le traitement des boues anodiques est principalement réalisé, après un traitement de lixiviation du cuivre, en général dans un autoclave, avec de l’acide sulfurique, par grillage alcalin qui consiste à chauffer les boues, vers 530-650°C, en présence de carbonate de sodium, afin d’oxyder le sélénium et le tellure sous forme de sélénate et tellurate, dans lesquels le sélénium et le tellure possèdent le degré d’oxydation +6, comme celui du soufre dans les sulfates, puis à effectuer une lixiviation à l’aide d’une solution d’hydroxyde de sodium. Le sélénate de sodium passe en solution, le tellurate reste dans la phase solide. Ce dernier est à son tour lixivié par une solution diluée d’acide sulfurique selon la réaction :
Na2TeO4 + H2SO4 = TeO42- + 2 H+ + 2 Na+ + SO42-
Le tellurate est réduit en tellurite à l’aide d’acide chlorhydrique concentré selon la réaction :
TeO42- + 2 HCl = TeO32- + H2O + Cl2
Puis le tellurite est réduit en tellure, qui précipite, par du dioxyde de soufre.
TeO32- + 2 SO2 + H2O = Te + 2 H+ + 2 SO42-
Le tellure obtenu contient des traces de sélénium. Il est purifié par électrolyse de l’acide tellureux en solution dans l’hydroxyde de sodium. On obtient du dioxyde de tellure qui dissout dans l’acide chlorhydrique est ensuite réduit en tellure par le dioxyde de soufre.
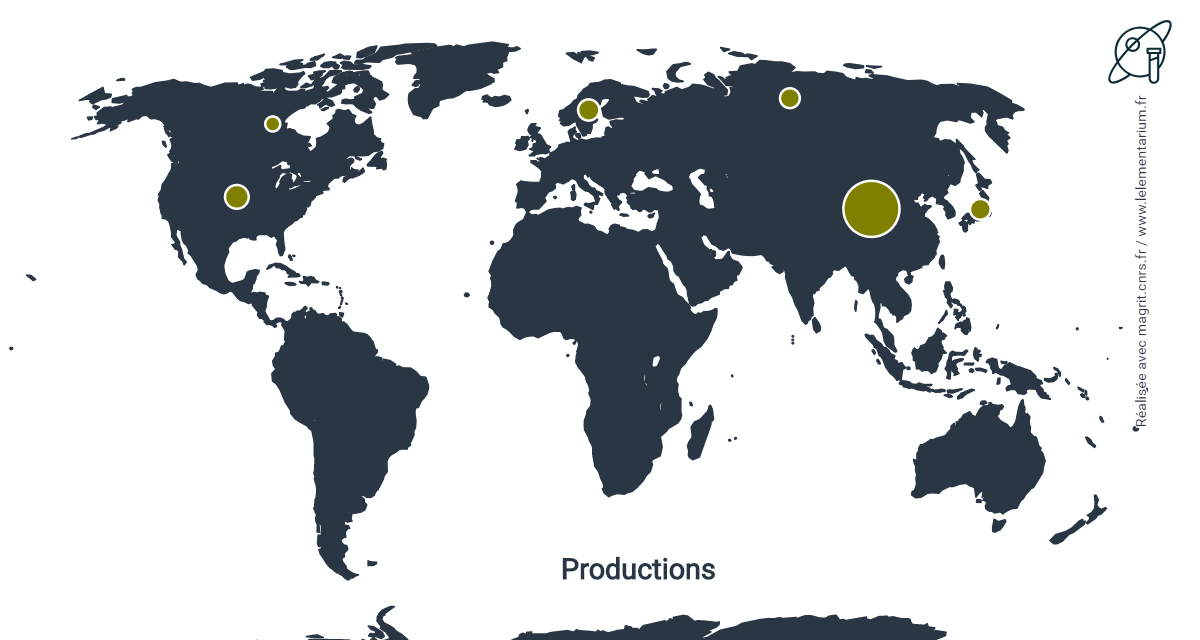
Productions
En 2019. Monde : 470 t.
| Chine | 290 | Suède | 40 | |
| Japon | 55 | Canada | 30 | |
| Russie | 40 | Bulgarie | 5 |
Source : USGS
Aux États-Unis, un seul producteur exporte au Mexique les boues d’électrolyse de cuivre par anode soluble afin de les traiter et extraire, en particulier, le tellure. Il s’agit d’Asarco, filiale de Grupo Mexico, à Amarillo, au Texas.
D’autres pays, producteurs de cuivre, produisent également du tellure mais leurs productions ne sont pas connues.
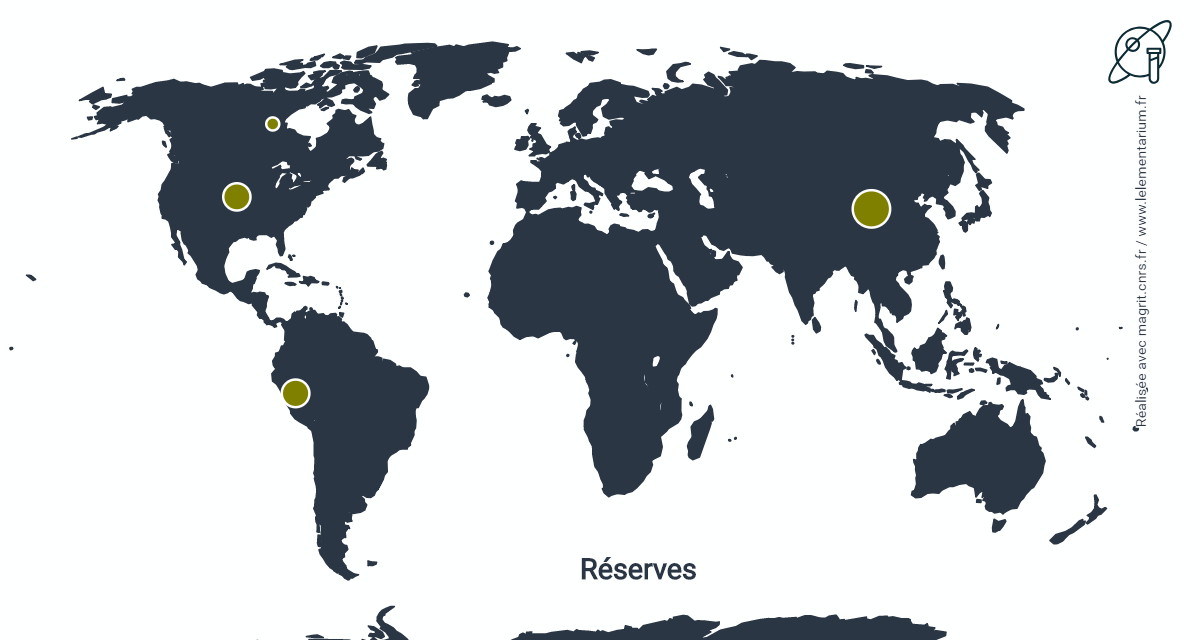
Réserves : estimées, en 2019, à partir des dépôts sulfurés de cuivre, elles sont de 31 000 t.
| Chine | 6 600 | États-Unis | 3 500 | |
| Pérou | 3 600 | Canada | 800 |
Source : USGS
Toutefois, les réserves du Chili, de Zambie, de la République Démocratique du Congo, producteurs importants de cuivre, ne sont pas évaluées par l’USGS.
Producteurs : on retrouve les principaux producteurs de cuivre.
- Glencore, a produit, en 2009, 40 t de tellure.
- Grupo Mexico produit du tellure à travers ses filiales, Asarco, aux États-Unis, à Amarillo, au Texas et Southern Copper, à Ilo, au Pérou et La Caridad au Mexique.
- Umicore, dans sa raffinerie de Hoboken, en Belgique, possède une capacité de production de 150 t/an.
- Boliden, produit des concentrés de tellurure de cuivre à partir du minerai de la mine souterraine de Kankberg, en Suède, avec, fin 2019, des réserves prouvées de 3 110 t de minerai renfermant 179 g/t de tellure, 3,3 g/t d’or et 11 g/t d’argent. L’exploitation de la mine a débuté en 2012 et a produit, en 2019, 40,953 t de tellure contenu dans les concentrés miniers.
Recyclage
Il est très peu développé.
Situation française
En 2019.
Les exportations de tellure étaient de 4,208 t avec comme principaux marchés à :
- 48 % la Turquie,
- 4 % les États-Unis.
Les importations de tellure s’élevaient à 7,152 t en provenance principalement à :
- 91 % de Belgique,
- 7 % du Canada.
Utilisations
Secteurs d’utilisation : en 2019, dans le monde.
| Photovoltaïque | 40 % | Métallurgie | 15 % |
| Thermoélectricité | 30 % | Caoutchouc | 5 % |
En Chine, les applications en thermoélectricité représentent 50 % de la consommation, celles en photovoltaïque, 40 %.
- Photovoltaïque : employé pour élaborer des couches minces de tellurure de cadmium (CdTe).
- Thermoélectricité : sous forme de tellurure de bismuth, Bi2Te3, il possède la capacité de transformer la chaleur en électricité, par effet Peltier. Cette propriété est, en particulier, employée en réfrigération portable.
- Métallurgie : il entre comme ajout dans le cuivre et les aciers, à une teneur de 50 à 80 g/t pour ces derniers, pour faciliter leur usinage. Il augmente la résistance à la corrosion et à la fatigue du plomb et de l’étain.
- Industrie du caoutchouc : il accélère la vulcanisation du caoutchouc.
- Électronique : semi conducteur, il est employé en imagerie thermique comme détecteur de radiations, ainsi que comme détecteur de rayons X.
Bibliographie
- A.S. Audion et J.F. Labbé, Compagnie Européenne d’Intelligence Stratégique (CEIS) (2010), « Panorama du marché 2010 du tellure« , rapport final BRGM/RP- 60206- FR.
- P. Blazy et E.A. Jdid, « Métallurgie du sélénium et du tellure », Techniques de l’Ingénieur, juin 2008.