Le méthanol est un composé toxique synthétisé à partir du gaz de synthèse, mélange de dihydrogène et de monoxyde de carbone, lui même obtenu par vaporeformage du gaz naturel ou par gazéification du charbon, particulièrement en Chine. Il est destiné principalement à fabriquer le formaldéhyde mais est aussi utilisé dans des carburants, après transformation éventuelle en MTBE, pour produire l’acide acétique et le diméthyléther, employé dans le GPL. Il est également utilisé pour produire de l’éthylène et du propylène, en Chine, et dans des piles à combustible.
Données physico-chimiques
Données atomiques
| Formule | Masse molaire | Moment dipolaire |
| CH3OH | 32,04 g.mol-1 | 1,69 D |
Données physiques
| Masse volumique | Température de fusion | Température d’ébullition | Température critique | Pression critique | Température point triple | Pression point triple | Limites d’explosivité dans l’air, en volume | Température d’autoinflammation | Conductibilité thermique | Conductibilité électrique | Solubilité dans l’eau |
| liquide, à 20°C, 101,3 kPa : 0,7915 g.cm-3 | -97,6°C | 64,6°C | 239°C | 8 084 kPa | -97,7°C | 1,86.10-1 Pa | 6,0 % – 36,5 % | 464°C | 207 mW.m-1K-1 | 5.10-9 Ω-1cm-1 | Infinie |
Données industrielles
Matières premières
Le méthanol ou alcool méthylique est, dans le monde en 2018, synthétisé à 52 % à partir du gaz naturel, à 35 % à partir du charbon, à 12 % à partir du gaz de cokerie et à 1 % à partir de pétrole. En Chine, en 2018, 82 % de la production provient du charbon, 10 % du gaz de cokerie et 8 % du gaz naturel. Les unités de production sont situées à proximité des gisements de gaz naturel, des gazoducs ou, en Chine, des mines de charbon.
Fabrication industrielle
Elle débute par la fabrication du gaz de synthèse suivie par celle du méthanol.
Obtention du gaz de synthèse à partir du gaz naturel :
Dans un premier temps, le gaz naturel subit un reformage catalytique en présence de vapeur d’eau. Le bilan des transformations est résumé par l’équilibre suivant qui donne le gaz de synthèse :
CH4 + H2O = CO + 3 H2
Ce reformage étant la principale source de dihydrogène, il est approfondi dans le chapitre consacré à ce gaz.
Obtention du gaz de synthèse à partir du charbon :
Lorsque le gaz naturel est remplacé par le charbon, comme cela est principalement le cas en Chine, la gazéification du charbon permet d’obtenir du gaz de synthèse selon la réaction suivante :
C + H2O = CO + H2 ΔrH° = + 131 kJ/mol
Cette réaction qui permettait, avant le développement de l’utilisation du gaz naturel, d’obtenir le gaz de ville, appelé également gaz à l’eau ou gaz manufacturé, est ainsi de nouveau mise en œuvre à grande échelle, en particulier en Chine. Depuis 1983, aux États-Unis, Eastman produit ainsi du gaz de synthèse pour synthétiser du méthanol, à Kingsport dans le Tennessee avec une capacité de production de 195 000 t/an, destinée à la fabrication d’acide acétique.
Synthèse du méthanol :
Le gaz de synthèse, obtenu à partir du gaz naturel, vers 830°C, sous une pression de 18 bar, possède la composition suivante en volume : H2 (72 %), CO (13 %), CO2 (8 %), impuretés (eau, méthane). Il est alors refroidi et comprimé (15 à 100 bar), puis introduit dans le réacteur de synthèse. Les réactions ont lieu vers 250°C, en présence d’un catalyseur aux oxydes de cuivre et de zinc sur alumine (durée de vie de 3 ans) :
CO + 2 H2 = CH3OH ΔrH° = – 108 kJ/mol
CO2 + 3 H2 = CH3OH + H2O ΔrH° = – 68 kJ/mol
Les réactions étant exothermiques, il est nécessaire de refroidir le mélange réactionnel par une trempe (introduction de diazote froid dans le réacteur).
Le mélange final contient 75 % de méthanol et 25 % d’eau. Une distillation permet de séparer le méthanol des impuretés (eau, éthanol, diméthyléther, formiate de méthyle).
Les capacités de production des usines les plus modernes peuvent atteindre 5 400 t/jour.
Biométhanol :
Du bio-méthanol peut être produit à partir de diverses sources, par exemple le biogaz ou les liqueurs noires de l’industrie papetière mais la source la plus importante, exploitée commercialement, est actuellement la glycérine (C3H5(OH)3). La société Bio MCN appartenant au groupe OCI depuis juin 2015, produit, à partir de glycérine brute, sous produit de la fabrication de biodiesel, du méthanol, à Delfzijl, aux Pays Bas. La glycérine brute est purifiée, puis craquée pour donner du gaz de synthèse qui est converti en méthanol.
En Islande, Carbon Recycling International (CRI) produit du biométhanol, 4 000 t/an, à Svartsengi près de Grindavik, à partir d’émissions géothermiques de dioxyde de carbone et de dihydrogène produit par électrolyse de l’eau. Ce procédé est intéressant lorsque l’électricité est produite à bas coût, comme cela est le cas en Islande grâce à la géothermie.
Au Canada, la société Enerkem, a construit, à Edmonton, en Alberta, une usine de fabrication de biométhanol à partir de déchets urbains, avec une capacité de production de 30 000 t/an. Une usine de démonstration est en fonctionnement, depuis 2009, à Westbury, au Québec, avec une capacité de production de 4 000 t/an.
En Suède, la société Chemrec, construit, à Pitea, une usine de gazéification des liqueurs noires sous-produites par l’industrie papetière, destinée à produire du méthanol transformé en diméthyléther, avec une capacité de production de 140 000 t/an de biométhanol.
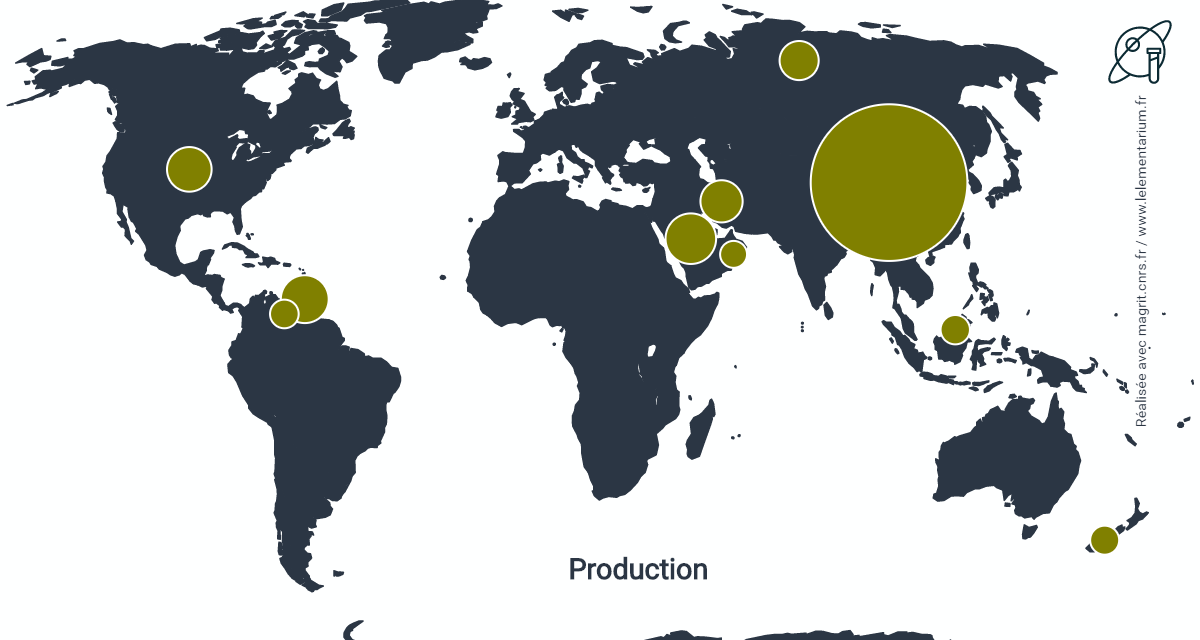
Productions
Capacités annuelles de production, en 2016. Monde, en 2019 : 146 millions de t/an, Union européenne (Allemagne, Pays Bas, Roumanie) : 2,555 millions de t/an.
| Chine | 70 958 | Russie | 4 418 | |
| Arabie Saoudite | 7 390 | Malaisie | 2 490 | |
| Trinidad et Tobago | 6 620 | Nouvelle Zélande | 2 430 | |
| États-Unis | 5 750 | Venezuela | 2 370 | |
| Iran | 5 144 | Oman | 2 095 |
Source : MMSA
En 2019, la production mondiale est de 97 millions de t dont, en 2014, 36,751 millions de t en Chine, 6,319 millions de t en Arabie Saoudite, 5,481 millions de t par Trinidad et Tobago, 3,289 millions de t en Russie, 3,183 millions de t en Iran, 2,326 millions de t aux États-Unis, 2,013 millions de t en Nouvelle Zélande, 1,751 million de t en Oman, 1,478 million de t en Malaisie.
En 2019, la production de l’Union européenne est de 2,4 millions de t dont 1 398 146 t en Allemagne et 13 163 t en France.
Mi-2018, avec le démarrage de l’usine Natgasoline, détenue à 50 % par OCI et 50 % par Consolidated Energy Limited (CEL), à Beaumont, au Texas, la capacité de production des États-Unis a atteint 7,5 millions de t/an et devrait atteindre 9,4 millions de t/an fin 2020.
En 2018, la capacité de production de la Chine est de 84,3 millions de t/an.
En dehors de la Chine, les principaux pays producteurs sont les plus importants pays producteurs de gaz naturel (Arabie Saoudite, Iran, Russie…). Depuis le développement de la production de gaz de schiste aux États-Unis, on assiste à un retour de la production dans ce pays avec diverses usines en construction ou qui redémarrent.
En 2016, dans le monde, il y a 333 unités de production dont 241 en Chine, 11 en Russie, 8 aux États-Unis, 8 en Arabie Saoudite, 7 à Trinidad et Tobago, 6 en Inde, 5 en Allemagne, 5 en Iran…
Commerce international : il a porté, en 2018, sur 26,993 millions de t.
Principaux pays exportateurs, en 2019, en milliers de t :
| Trinidad et Tobago, en 2018 | 5 163 | Russie | 2 108 | |
| Iran, en 2018 | 4 313 | Malaisie | 1 763 | |
| Arabie Saoudite | 4 308 | Nlle Zélande, en 2018 | 1 525 | |
| États-Unis | 2 570 | Chili | 862 | |
| Pays Bas | 2 212 | Égypte | 713 |
Source : ITC
Les exportations de l’Arabie Saoudite sont destinées principalement à 27 % à la Chine, 23 % au Japon, 9 % à Taipei chinois.
Principaux pays importateurs, en 2019, en milliers de t :
| Chine | 10 896 | Japon | 1 697 | |
| États-Unis | 3 102 | Allemagne | 1 373 | |
| Pays Bas | 2 741 | Taipei chinois | 1 292 | |
| Inde | 2 311 | Brésil | 1 223 | |
| Corée du Sud | 1 775 | Thaïlande | 806 |
Source : ITC
Les importations de la Chine proviennent principalement à 28 % d’Iran, 16 % de Nouvelle Zélande, 11 % de Trinidad et Tobago, 10 % d’Oman, 10 % d’Arabie Saoudite, 9 % des Émirats Arabes Unis.
Principaux producteurs, en 2019 :
| Methanex (Canada) | 9 150 | Yankuang (Chine) | 5 400 | |
| Proman/Helm | 6 910 | OCI | 3 861 | |
| Sabic (Arabie Saoudite) | 6 300 | Petronas (Malaisie) | 2 400 | |
| Zagros (Iran) | 5 600 | Mitsubishi Gas Chemical (Japon) | 2 000 |
Sources : rapports des sociétés et Methanex
- A partir de gaz naturel, Methanex a produit, en 2019, 7,589 millions de t de méthanol :
- En Nouvelle Zélande, à Motunui et Waitara Valley, avec une capacité de production de 2,2 millions de t/an et une production de 1,865 million de t.
- A Trinidad et Tobago avec les sociétés Titan et à 63,1 % Atlas et des capacités respectives de production de 875 000 t/an et 1,125 million de t/an et une production de 1,743 million de t.
- En Égypte, à Damiette, avec 50 % de la société EMethanex et une capacité propre de production de 630 000 t/an et une production de 392 000 t.
- Au Chili, à Punta Arenas, avec une capacité de production nominale de 1,72 million de t/an. Les unités de production fonctionnant à partir de gaz naturel argentin, les difficultés d’approvisionnement ont entraîné en partie leur migration aux États-Unis. La production, en 2019, est de 1 050 000 t.
- Au Canada, dans la province d’Alberta, à Medecine Hat, avec une capacité de production de 600 000 t/an et une production de 610 000 t.
- Aux États-Unis, à Geismar, en Louisiane, avec une capacité de production de 2 millions de t/an issue du redéploiement d’unités de production chiliennes. Les deux unités de production sont devenues opérationnelles en janvier et décembre 2015. En 2019, la production a été de 1,929 million de t. Une nouvelle usine est en cours de construction avec une capacité de production prévue, fin 2022, de 1,8 million de t/an.
- Proman qui a créé avec le groupe Helm une joint venture dans le méthanol possède des unités de production à Trinidad et Tobago, au travers de sa filiale Methanol Holdings (MHTM) qui possède 5 unités de production à Point Lisas, avec une capacité de production de 4,045 millions de t/an ainsi qu’à Oman, avec une participation dans Oman Methanol Company, qui possède à Sohar une capacité de production en propre de 1,05 million de t/an et aux États-Unis à Pampa, au Texas avec 65 000 t/an. Par ailleurs, a construit avec OCI, aux États-Unis, à Beaumont, au Texas, une usine, Natgasoline, d’une capacité en propre de 1,75 million de t/an qui est opérationnelle depuis mi-2018.
- Zagros (Iran), possède une capacité de production de 3,3 millions de t/an, à Assaluyed et depuis février 2019, de 2,3 millions de t/an à Kaveh.
- OCI, produit du méthanol, aux États-Unis, à Beaumont, au Texas, avec une capacité de 1,045 million de t/an. A acquis, en juin 2015, l’usine de biométhanol de la société Bio MCN située à Delfzijl, aux Pays Bas, avec une capacité de production de 991 000 t/an en partie à l’aide de glycérol et a construit, sur le site de Beaumont, au Texas, une nouvelle usine, détenue à parts égales avec Proman, Natgasoline, qui est opérationnelle depuis mi-2018, avec une capacité de production, pour OCI, de 1,825 million de t/an. En 2019, les ventes de méthanol ont été de 1,629 million de t.
- Mitsubishi Gas Chemical participe à des joints venture à Brunei (50 %), avec 850 000 t/an de capacité totale, à Jubail, en Arabie Saoudite, dans Saudi Methanol Company (23,5 %), avec 4,85 millions de t/an de capacité totale et à Jose, au Venezuela, dans 23,75 % de Metor, avec 1,6 million de t/an de capacité totale. Une usine est en cours de construction, en association avec Mitsubishi Corporation, à Trinidad & Tobago.
Situation française
En 2019.
La production est de 13 163 t.
Commerce extérieur :
Les exportations étaient de 3 033 t avec comme principaux marchés à :
- 39 % l’Allemagne,
- 22 % l’Espagne,
- 8 % le Royaume Uni.
Les importations s’élevaient à 621 288 t en provenance principalement à :
- 41 % de Trinidad et Tobago,
- 29 % d’Égypte,
- 11 % des États-Unis,
- 9 % des Pays Bas.
Utilisations
Consommations
Dans le monde, en 2019 : 97 millions de tonnes :
Répartition de la consommation, en 2018 :
| Chine | 53 % | Amérique du Nord | 10 % | |
| Asie (hors Chine) | 18 % | Amérique latine | 3 % | |
| Europe | 12 % |
Source : Methanex
Évolution de la demande entre 2000 et 2015 :
| 2000 | 2015 | ||
| Chine | 12 % | 54 % | |
| Amérique du Nord | 33 % | 11 % | |
| Europe de l’Ouest | 22 % | 10 % |
Source : IHS Markit
Secteurs d’utilisation
Dans le monde, en 2019.
| Formaldéhyde | 25 % | Biodiesel | 3 % | |
| Source d’oléfines | 24 % | Diméthyléther | 3 % | |
| Additif ou substitut à l’essence | 13 % | Dichlorométhane | 3 % | |
| MTBE | 12 % | Méthacrylate de méthyle | 2 % | |
| Acide acétique | 8 % | Méthylamines | 2 % |
Source : MMSA
Autres : Méthyl mercaptan, diméthyl terephthalate…
Le méthanal (formaldéhyde) est actuellement le principal débouché du méthanol, mais ce dernier est de plus en plus utilisé dans les carburants, soit directement, soit après transformation en méthyltertiobutyléther (MTBE). En 2017, 29 % de la consommation mondiale de méthanol a concerné un emploi comme carburant. En Chine, en 2011, la consommation dans les carburants a été de 7 millions de t, le carburant le plus utilisé, M15, contenant 15 % de méthanol. Par ailleurs, on assiste au développement de l’utilisation du méthanol en remplacement du fuel lourd employé dans le transport maritime afin de diminuer les émissions d’oxydes de soufre et d’azote.
Le formaldéhyde, est principalement commercialisé sous forme de formol, solution aqueuse à 37 % de formaldéhyde. C’est un constituant des colles urée-formaldéhyde et phénol-formaldéhyde destinées à la fabrication du contre-plaqué, des panneaux de particules…
La production d’alcènes ou oléfines (éthylène, propylène…) à partir de méthanol se développe en Chine, ce pays, riche en charbon mais relativement pauvre en ressources pétrolières produit ainsi des oléfines à partir de charbon en passant par la production de méthanol. La production d’une tonne d’oléfines demande 3 tonnes de méthanol. Le procédé MTO (Methanol-To-Olefins) développé par Honeywell UOP et Ineos permet à partir de méthanol de produire des oléfines à l’aide d’un catalyseur silico-alumino-phosphate (SAPHO-34). Le rendement en éthylène (C2) et propylène (C3) peut être augmenté jusqu’à 89 % à l’aide du procédé OCP (Olefin Cracking Process), développé par Total et UOP, de craquage des oléfines plus lourdes (de C4 à C6) en C2 et C3. Une unité de démonstration a été construite par Total, en 2008, à Feluy en Belgique, permettant à partir du méthanol d’obtenir du polyéthylène et du polypropylène en passant par l’éthylène et le propylène. En 2015, 13 usines sont en fonctionnement en Chine.
L’acide acétique (CH3COOH) est principalement formé par carbonylation du méthanol, en trois étape, en passant par la formation d’iodométhane. La carbonylation est catalysée par des catalyseurs au rhodium, dans le procédé Monsanto ou à l’iridium plus récemment.
CH3OH + HI = CH3I + H2O
CH3I + CO = CH3COI
CH3COI + H2O = CH3COOH + HI
Il est utilisé pour synthétiser l’acétate de vinyle, l’anhydride acétique, l’acide téréphtalique et le téréphtalate de diméthyle destiné à fabriquer le polyéthylènetéréphtalate (PET)…
Le diméthyléther (CH3OCH3) peut entrer, jusqu’à 20 %, dans le gaz de pétrole liquéfié (butane et propane). Il est produit par déshydratation du méthanol selon la réaction :
2 CH3OH = CH3OCH3 + H2O
Parmi les autres débouchés, on peut citer la fabrication du formiate de méthyle, de méthylamines, du méthyl mercaptan, du biodiesel par transestérification qui par ailleurs produit de la glycérine qui peut être transformée à son tour en biométhanol…
Le méthanol est utilisé dans des piles à combustible. En 2014, la consommation mondiale dans ce secteur est de 8 000 t. Il existe deux types de piles :
- Les piles RMFC (Reformed Methanol Fuel Cell) où le méthanol est reformé pour produire le dihydrogène qui alimentera la pile.
- Les piles DMFC (Direct Methanol Fuel Cell) où le méthanol est directement oxydé dans le cœur de la pile et ne nécessite pas d’être reformé.
Contrairement au dihydrogène, le méthanol, liquide à température ambiante, constitue un moyen simple et efficace de stockage de l’énergie.
Le méthanol est utilisé pour aider à la dénitrification des eaux usées avant leur rejet dans l’environnement. Il accélère l’activité des bactéries anaérobies des stations d’épuration qui transforment les ions nitrate en diazote.
L’alcool à brûler contient, outre environ 90 % d’éthanol, de 5 à 10 % de méthanol, destiné à le dénaturer.
Toxicité
Le méthanol est un composé classé toxique (pictogramme T) : la dose létale (DL50) est comprise entre 6 et 14 g/kg de divers animaux (rat, chat, chien…) par voie orale et de 16 g/kg de lapin par voie cutanée. Une absorption de 100 à 250 mL peut-être mortelle pour l’homme, bien que des cas de mort soient survenus pour moins de 30 mL. Une absorption moindre peut causer la cécité.
Le méthanol étant volatil, il faut se protéger de ses vapeurs dont la concentration létale (CL50) est de 65 000 ppm (sur le rat). La valeur moyenne limite d’exposition (VME) est de 200 ppm et la valeur limite d’exposition (VLE) est de 1 000 ppm, valeurs inférieures au seuil de détection olfactif qui est d’environ 2 000 ppm.
En France, le méthanol est généralement dénaturé avec 3,5 % d’un mélange complexe (obtenu par carbonisation du bois et contenant 65 % de méthanol, des cétones et diverses impuretés) et 1 % de 2-propanol qui donnent un goût et une odeur désagréables.
Bibliographie
Gaz naturel
Les micro-organismes animaux ou végétaux (plancton...) qui se sont déposés, il y a plusieurs millions d'années, au fond des océans sont à l'origine du pétrole et du gaz naturel qui après divers mouvements de circulation se retrouvent sous des dômes de terrain imperméable.
En savoir plus