Depuis l’Antiquité, un minerai nommé kadmeia est extrait de mines près de Thèbes. En 1817, le chimiste allemand Friedrich Stromeyer analyse ce carbonate de zinc et découvre un nouvel élément qu’il nomme d’après le minerai, aujourd’hui connu sous le nom de calamine.
Données physico-chimiques
Données atomiques
| Numéro atomique | Masse atomique | Configuration électronique | Structure cristalline | Rayon métallique pour la coordinence 12 |
| 48 | 112,41 g.mol-1 | [Kr] 4d10 5s2 | hexagonale compacte de paramètres a = 0,2979 nm et c = 0,5619 nm | 156,8 pm |
Données physiques
| Masse volumique | Dureté | Température de fusion | Température d’ébullition | Conductibilité électrique | Conductibilité thermique | Solubilité dans l’eau |
| 8,642 g.cm-3 | 2 | 320,9°C | 765°C | 13,8.106 S.m-1 | 96,8 W.m-1.K-1 | insoluble |
Données chimiques
| Électronégativité de Pauling | pKa : Cdaq2+ /CdOHaq+ | E° : Cd2+ + 2e = Cd(s) | E° : Cd2+ + (Hg) + 2e = Cd(Hg)(s) | pKs : CdCO3 | pKs : Cd(OH)2 | pKs : CdS | pKs : Cd(IO3)2 |
| 1,69 | 9 | -0,40 V | -0,35 V | 11,3 | 13,5 | 27,7 | 7,5 |
Données thermodynamiques
Cadmium alpha :
|
Cadmium gazeux :
|
Données industrielles
Matières premières
La teneur moyenne de l’écorce terrestre est de 0,15 ppm.
Il n’existe pas de minerai de cadmium en quantités exploitables.
Le cadmium est principalement associé au zinc dans les minerais de zinc, avec une teneur en Cd comprise entre 0,01 et 0,05 % et de 0,2 à 0,3 % dans les concentrés de minerai. Il est donc co-produit de la métallurgie du zinc qui donne de 1,8 à 6 kg de cadmium par tonne de zinc élaboré et en moyenne 3 kg/t de Zn. Sa production est en conséquence proportionnelle à celle du zinc.
Le cadmium est également présent dans des minerais de plomb et de cuivre, ainsi que dans des phosphates naturels (34 ppm pour les phosphates jordaniens, 380 ppm pour les phosphates tunisiens). Dans ce dernier cas, divers procédés de décadmiage peuvent être mis en œuvre.
Métallurgie
La métallurgie du cadmium est une activité industrielle connexe à celle du zinc. Dans tous les cas, une partie du cadmium est récupérée par filtration du gaz provenant du grillage des concentrés miniers (voir le chapitre consacré au zinc).
Lors de la pyrométallurgie du zinc : le cadmium restant est récupéré lors du raffinage du zinc. L’éponge de cadmium obtenue est raffinée thermiquement par fusion, à 450°C, en présence de soude pour éliminer Zn et Pb sous forme de zincate et plombate puis par distillation à 770°C.
Lors de l’hydrométallurgie du zinc, le cadmium restant est en solution (0,2 à 0,3 g de Cd2+/L) dans le bain destiné à l’électrolyse du zinc. Avant celle-ci, il est récupéré, avec le cuivre présent, par cémentation à l’aide de zinc. On obtient des « boues bleues » contenant environ 6 % de cadmium et 15 % de cuivre qui sont ensuite attaquées à l’aide d’acide sulfurique. Le cadmium passe en solution alors que le cuivre reste inattaqué. Les ions Cd2+ sont à nouveau réduits en métal par cémentation par le zinc. Le raffinage a lieu soit par briquetage du cément de cadmium-zinc et distillation (les températures d’ébullition, à la pression atmosphérique, sont de 767°C pour Cd et 907°C pour Zn), soit par lixiviation à l’acide sulfurique et électrolyse avec anode en plomb et cathode en aluminium.
Recyclage
En 2016, le taux de recyclage, est estimé, à l’échelle mondiale, à 20 %, principalement à partir des accumulateurs Ni-Cd, qui sont pratiquement à 100 % recyclables. Le cadmium est facilement récupéré, essentiellement par pyrométallurgie, du fait de sa température peu élevée d’ébullition, 767°C sous une atmosphère. Des procédés hydrométallurgiques de recyclage sont aussi utilisés.
Dans l’Union européenne :
- La société française SNAM (Société Nouvelle d’Affinage de Métaux), filiale du groupe belge Floridienne, a produit, à Viviez (12) et Saint Quentin Fallavier (38), en 2013, 360 t de cadmium recyclé, représentant 50 % du marché de l’Union européenne.
- La société Eurodieuze Industries, filiale de Veolia, située à Dieuze (57) met en œuvre un procédé hydrométallurgique.
- Saft, filiale de Total, recycle ses batteries Ni-Cd dans son usine d’Oskarshamn, en Suède.
- La société Accurec, recycle par pyrométallurgie les métaux des batteries Ni-Cd, dans son usine de Mülheim, en Allemagne.
Aux États Unis :
La société Retriev Technologies, recycle par pyrométallurgie des batteries Ni-Cd, à Lancaster dans l’Ohio.
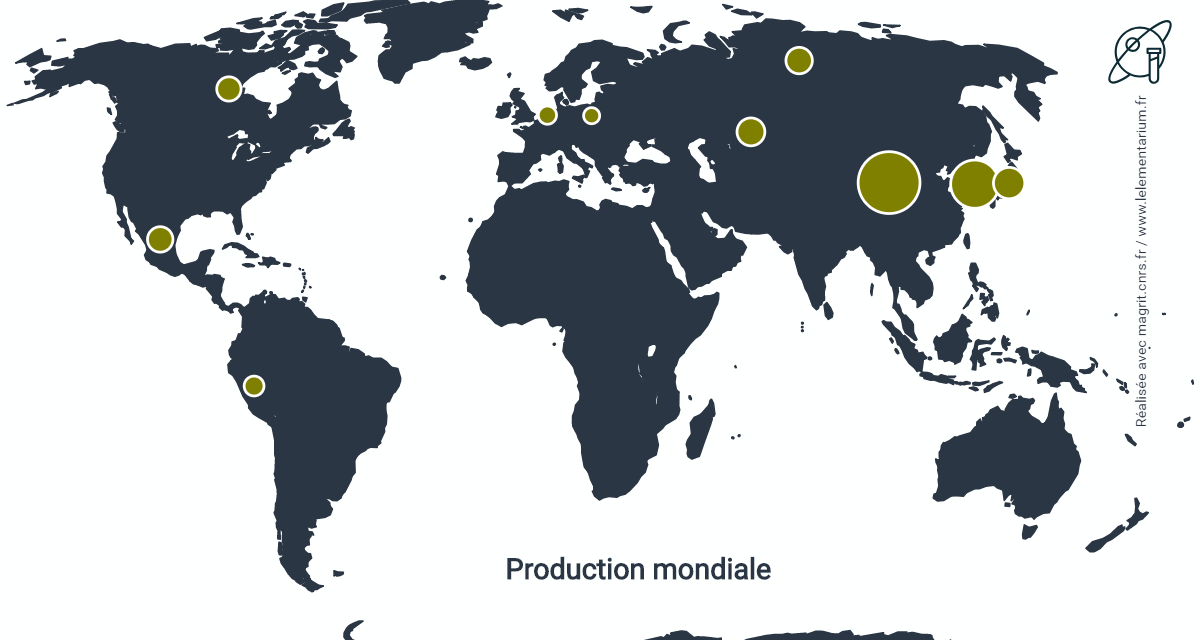
Productions
En 2019. Monde, hors États-Unis : 25 000 t, Union européenne, en 2016 : 1 770 t.
| Chine | 8 200 | Mexique | 1 400 | |
| Corée du Sud | 5 000 | Pays Bas | 1 100 | |
| Japon | 1 900 | Russie | 1 000 | |
| Canada | 1 600 | Pérou | 770 | |
| Kazakhstan | 1 400 |
Depuis 2011, la production des États-Unis est confidentielle.
Commerce international : en 2019.
Principaux pays exportateurs sur un total de 17 374 t :
| Corée du Sud | 3 688 | Émirats Arabes Unis | 932 | |
| Chine | 1 858 | Pays Bas | 925 | |
| Canada | 1 528 | Ouzbékistan | 855 | |
| Japon | 1 516 | Pérou | 786 | |
| Kazakhstan | 1 161 | Hong Kong | 690 |
Source : ITC
Les exportations de la Corée du Sud sont destinées à 41 % à l’Inde, 41 % à la Chine, 17 % à Hong Kong.
Principaux pays importateurs sur un total de 17 131 t :
| Inde | 7 878 | Vietnam | 716 | |
| Chine | 4 055 | États-Unis | 405 | |
| Belgique | 1 439 | Russie | 326 | |
| Suède | 959 | Espagne | 175 | |
| Hong Kong | 732 | France | 143 |
Source : ITC
Les importations de l’Inde proviennent à 19 % de Chine, 14 % de Corée du Sud, 12 % des Émirats Arabes Unis, 11 % du Japon.
Producteurs : les principaux producteurs sont les producteurs de zinc ainsi que les sociétés recyclant les batteries Ni-Cd.
En Corée du Sud, les principaux producteurs sont :
- Korea Zinc, à Onsan, avec une capacité de production de 3 000 t/an.
- Young Poong, à Sukpo, avec une capacité de production de 1 750 t/an.
Au Japon, les principaux producteurs sont :
- Mitsui Metal Mining Company, à Hachinohe et Kamioka.
- Dowa Metals and Mining, à Akita.
- Sumitomo Metal and Mining, à Harima.
- Toho Zinc, à Annaka.
Au Canada, la production est assurée par Teck, à Trail, en Colombie Britannique, avec une capacité de production de 1 400 t/an.
Au Mexique, les principaux producteurs sont :
- Industrias Peñoles, à Torreón, avec une production de 600 t, en 2019.
- Grupo México, à San Luis de Potosi, avec une production de 609 t, en 2019.
Au Kazakhstan, la production est assurée principalement par Kazzinc, détenu à 69,7 % par Glencore, à Ust-Kamenogorsk.
En Russie, la production est principalement assurée par Chelyabinsk Zinc Plant OJSC et Ural Mining and Metallurgical Company.
Au Pérou, la production est principalement assurée par Nexa, à Cajamarquilla.
Aux États-Unis, la production primaire est assurée par Nyrstar avec son usine de Clarksville dans le Tennessee.
Aux Pays Bas, la production est réalisée par Nyrstar, à Budel.
En Pologne, la production est assurée par Huta Cynku, dans la raffinerie de Miasteczko Slaskie.
En Inde, la production est principalement réalisée par Hindustan Zinc, filiale de Vedanta, à Chanderiya et Debari, avec une capacité de production de 718 t/an.
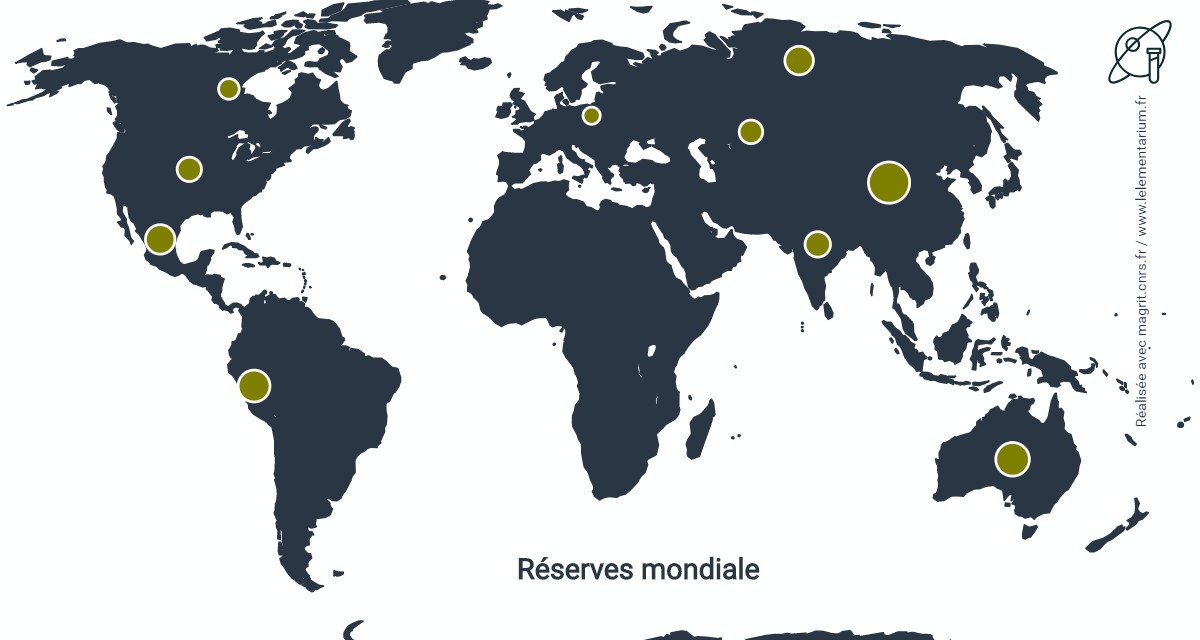
Réserves : dans le monde, en 2013 : 500 000 t.
| Chine | 92 000 | Inde | 35 000 | |
| Australie | 61 000, en 2011 | États-Unis | 32 000 | |
| Pérou | 55 000 | Kazakhstan | 30 000 | |
| Mexique | 47 000 | Canada | 23 000 | |
| Russie | 44 000 | Pologne | 16 000 |
Source : USGS
Les réserves de cadmium sont estimées à partir de celles de zinc sur la base d’un rapport de 1 pour 200 à 400.
Situation française
En 2019.
Production : la France n’a plus de production minière de cadmium depuis la fermeture, en décembre 1993, du gisement de zinc-germanium-argent de Saint-Salvy (81). La production provient principalement du recyclage de batteries Ni-Cd.
Commerce extérieur :
Exportations :
- Métal brut : 629 t vers la Belgique à 51 %, l’Inde à 47 %.
- Oxyde de cadmium : 24 t vers l’Allemagne à 5 %, le Canada à 4 %.
Importations :
- Métal brut : 143 t de Chine à 54 %, de Belgique à 43 %.
- Oxyde de cadmium : 95 t de Chine à 89 %, de Belgique à 7 %.
Utilisations
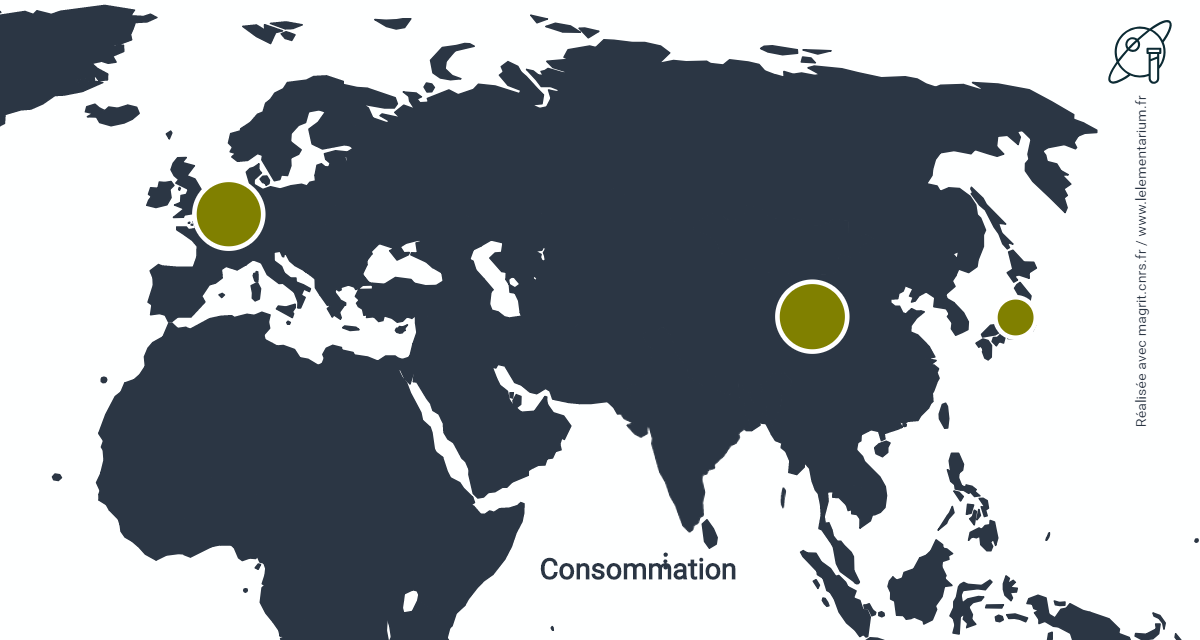
Consommations : en 2011, en t. Monde : 16 200 t.
| Chine | 5 350 | Japon | 1 800 | |
| Belgique | 5 200 |
La seconde place de la Belgique est liée à la présence de l’usine Flaurea Chemicals, située à Ath, dans le Hainaut, reprise, en 2014, par le groupe Aurea. Cette usine, importe du cadmium dont celui recyclé par la société SNAM, pour le transformer en différents sels ou poudres qui sont ensuite, en grande partie, exportés.
Secteurs d’utilisation : en 2011, dans le monde.
| Batteries Cd-Ni | 86 % | Galvanoplastie | 4 % | |
| Pigments | 9 % |
Utilisations diverses :
- Accumulateurs (batteries rechargeables) Ni-Cd :
La matière constituant l’anode est un mélange pulvérulent d’hydroxyde de nickel et de graphite. La matière active de la cathode est constituée d’hydroxyde de cadmium mélangé à d’autres substances. Ces matières actives sont déposées sur divers substrats métalliques. L’électrolyte est une solution aqueuse de KOH à 6 à 8 moles/L. Les réactions suivantes se produisent :
A l’électrode positive :
NiOOH + H2O + e = Ni(OH)2 + OH– avec E° = 0,49 V
A l’électrode négative :
Cd + 2OH– = Cd(OH)2 + 2e avec E° = – 0,809 V
Les batteries Ni-Cd portables (grand public) sont interdites dans l’Union européenne depuis la promulgation de la directive 2006/66/CE, avec quelques exemptions régulièrement réévaluées par la Commission européenne. Elles ne sont plus fabriquées dans l’Union européenne et sont exclusivement importées d’Asie. Depuis le 1er janvier 2017, dans l’Union européenne, toute utilisation de batteries Ni-Cd dans les outils sans fil est interdite.
Cependant, les batteries Ni-Cd industrielles restent la solution préférée dans les applications de secours pour lesquelles leurs caractéristiques de fiabilité et de robustesse mécanique (résistance aux chocs), thermique (large plage de température d’utilisation) et électrique (forte résistance aux abus électriques : en cas de surcharge ou décharge profonde) sont indispensables. C’est à ce titre qu’elles sont la solution de référence pour le secours électrique dans les matériels de transport publics (aéronautique, ferroviaire), des équipements médicaux, certains matériels industriels sensibles ainsi que les matériels de réseau (ex : stations de base de réseaux télécom dans les zones mal desservies et à climat rigoureux), et ce malgré un prix bien supérieur à la technologie standard plomb/acide.
Enfin, les caractéristiques électrochimiques de ces batteries leur permettent de faire l’objet d’une maintenance préventive par un suivi de leur vieillissement, elles échappent ainsi au phénomène de mort subite, inacceptable dans des applications de secours.
Ces batteries font l’objet d’une obligation de collecte et de recyclage à la charge des producteurs au titre de la directive 2006/66/CE. Ainsi, une fraction importante des matériaux utilisés dans la fabrication de nouvelles batteries est issue de batteries Ni-Cd usagées collectées et recyclées.
- Les pigments à base de sulfure de cadmium, jaune avec CdS, rouge avec Cd(S,Se) ou orange par mélange des précédents ont été utilisés à grande échelle dans les matières plastiques (gilets de sauvetage, casques de chantiers), verres, céramiques. Le jaune des tournesols de Van Gogh est donné par le sulfure de cadmium.
La Communauté européenne a adopté une directive qui n’interdit pas l’emploi des pigments de cadmium, mais restreint leur utilisation aux cas pour lesquels ils ne peuvent être remplacés, en particulier dans des polymères.
Les pigments à base de sulfure de cadmium sont remplacés par des pigments à base de sulfure de cérium. - Cadmiage : le cadmium est inaltérable à l’air et a un bon comportement en milieu marin. Le cadmiage est effectué par électrolyse. Utilisé, en particulier, pour protéger les rivets d’assemblage en aéronautique.
- Alliages à bas point de fusion, pour brasures de conducteurs électriques (Ag : 50 %, Cd : 18 %, Zn : 16 %, Cu : 15 %), pour fusibles (Bi : 50 %, Pb : 27 %, Sn : 13 %, Cd : 10 %, fond à 70°C).
- Le cadmium a un fort pouvoir d’absorption des neutrons thermiques.
- Des cellules photovoltaïques sont en tellurure de cadmium.
- Les sels de cadmium, principalement sous forme de stéarates et laurates, ont été longtemps utilisés comme stabilisant du PVC. Ils ne sont plus utilisés, dans l’Union européenne à 15, depuis 2001 et 2007 pour l’UE à 27. La teneur en cadmium dans le PVC destiné à la construction doit être inférieure à 0,1 %, sa présence étant due à l’emploi de PVC recyclé.
Toxicité et pollution
Toxicité, d’après les fiches de l’INERIS : les principaux risques d’intoxication par le cadmium sont actuellement liés aux expositions prolongées et à de faibles doses.
Les intoxications par le cadmium résultent d’une absorption par voies respiratoires ou digestives. L’absorption dépend de la solubilité des sels, par inhalation elle varie de 10 % pour le sulfure à 90-100 % pour le chlorure ; par voie digestive l’absorption est de 5 %. L’absorption par voie digestive de plus de 0,9 g ou par voie respiratoire de poussières à des concentrations supérieures à 200 mg/m3 peut entraîner des troubles graves. En France, la valeur limite d’exposition est fixée à 0,05 mg/m3, pour les fumées d’oxyde.
Transporté par l’hémoglobine, le cadmium se concentre préférentiellement, à 50-70 %, dans le foie et les reins, mais aussi dans le pancréas, la thyroïde, les testicules et les glandes salivaires. Dans les tissus, le cadmium se fixe sélectivement sur des protéines, les métallothionéines. La demi-vie du cadmium est de 20 à 30 ans dans le rein et de 30 jours dans le sang.
Dans le rein, la fixation du cadmium, entraîne des néphropathies irréversibles, une perte anormale de protéines par les urines (protéinurie), caractéristiques des insuffisances rénales.
Le cadmium se fixe également dans le squelette, par substitution du calcium de l’apatite, constituant minéral des os, donnant de l’ostéoporose avec des douleurs osseuses intenses observées lors de la maladie « d’itaï-itaï » survenue dans les années 50, au Japon, après consommation de riz contaminé.
L’intoxication chronique par le cadmium se traduit également par des cancers pulmonaires et prostatiques.
Sources de pollution : d’après les données du CITEPA, les émissions atmosphériques de cadmium ont été, en 2019, en France, de 2,6 tonnes, en diminution constante depuis 1990 où elles étaient de 21 t. L’origine des émissions est principalement dans la combustion de combustibles minéraux solides, de fioul lourd et de biomasse. La répartition est la suivante, en 2018 :
| Industrie manufacturière |
42 % | Agriculture | 12 % | |
| Transport | 19 % | Résidentiel | 8 % | |
| Énergie | 13 % | Déchets | 6 % |
Source : CITEPA
En France, en milieu urbain, la concentration atmosphérique en cadmium est comprise entre 1 et 10 ng/m3. Elle est comprise entre 0,1 et 0,5 ng/m3 en milieu rural. Dans l’Union européenne, les émissions par les volcans sont de 15 t/an avec une concentration de 30 µm/m3 près de l’Etna. La valeur limite proposée par l’OMS est de 5 ng/m3. En milieu professionnel, la VME est de 50 µg/m3. La consommation de tabac peut représenter jusqu’à 75 % de l’absorption alimentaire humaine quotidienne, 20 cigarettes apportant 2 µg.
En général, la concentration en cadmium des eaux douces est, en France, inférieure à 1 µg/L. La valeur limite pour les eaux de consommation est de 5 µg/L.
La principale origine du cadmium présent dans les organismes humains est l’alimentation et plus particulièrement, les poissons, crustacés, abats, légumes et céréales. Par exemple, les mollusques bivalves concentrent le cadmium d’un facteur 300 000. Le cadmium est présent dans les céréales et les légumes, son origine réside dans une présence naturelle dans les sols ainsi que dans les apports d’engrais phosphatés, l’apport de ces engrais étant de 2 à 6 g de Cd/ha/an. Le cadmium se concentre alors principalement dans les feuilles des plantes (salades, choux mais aussi tabac)… A noter que la tabagie est la source majoritaire d’absorption du cadmium chez les fumeurs.
Bibliographie
- Le cadmium en « questions », Collectif pour l’étude du cadmium, 30 Av de Messine, 75008 Paris.
- « Cadmium review« , Nordic Council of Ministers, janvier 2003.
- « Final review of scientific information on cadmium« , UNEP, décembre 2010.
- CITEPA, 7 Cité du Paradis, 75010 Paris.
- INERIS, Parc Technologique ALATA, BP 2, 60550 Verneuil-en-Halatte.
- L’Actualité Chimique, janvier, février 1992.
- International Cadmium Association (ICdA) 168, Av. de Tervuren, Box 4, B-1150 Bruxelles, Belgique.