Le rubidium a été découvert en 1960 par Robert Bunsen et Guastav Kirchhoff en chauffant de l’eau de source. Son nom vient du latin rubidus signifiant rouge foncé en référence à la couleur des raies spectrales qui leur ont permis de le détecter.
Données physico-chimiques
Données atomiques
| Numéro atomique | Masse atomique | Configuration électronique | Structure cristalline | Rayon métallique pour la coordinence 12 |
| 37 | 85,47 g.mol-1 | [Kr] 5s1 | cubique centrée de paramètre a = 0,562 nm | 254,6 pm |
Données physiques
| Masse volumique | Dureté | Température de fusion | Température d’ébullition | Conductibilité électrique | Conductibilité thermique, à 25°C | Solubilité dans l’eau |
|
0,3 | 38,89°C | 688 °C | 7,79.106 S.m-1 | 58,2 W.m-1.K-1 | oxydé en Rb+ avec dégagement de dihydrogène |
Données chimiques
| Électronégativité de Pauling | État d’oxydation le plus courant | E° : Rb+ + e = Rb(s) | E° : Rb+ + (Hg) + e = Rb(Hg) |
| 0,82 | +1 | -2,93 V | -1,81 V |
Données thermodynamiques
Rubidium cristallisé
|
Rubidium gazeux
|
Données industrielles
Le rubidium est naturellement constitué de deux isotopes 85Rb à 72,2 % en masse et 87Rb à 27,8 %, ce dernier étant radioactif avec une période de 49 milliards d’années. En conséquence, il est faiblement radioactif.
Matières premières
La teneur en rubidium (Rb) de l’écorce terrestre est de 78 ppm.
Il ne forme pas de minéraux propre et donc, c’est principalement un élément coproduit lors de l’exploitation de gisements de pegmatites renfermant du césium et du lithium. Il est présent à des teneurs d’environ 1 % dans la pollucite, Cs2Al2Si4O12, qui est le principal minéral de césium et à des teneurs comprises entre 0,3 et 3,5 % dans la lépidolite, (K,Rb)(Li,Al)3(Si,Al)4O10(F,OH)2, l’un des principaux minéraux contenant du lithium.
Par ailleurs, il est présent par substitution du potassium dans de nombreux minéraux, tels que des feldspaths, des micas, la carnallite, la sylvinite… dans lesquels il constitue une impureté qui accompagne le potassium dans ses utilisations.
Le principal gisement mondial est celui de Bernic Lake, au Canada, dans la province du Manitoba. Il était exploité souterrainement à 60 m sous le niveau du lac, par la société Tantalum Mining Corporation (Tanco), filiale de Cabot, et vendu, fin juin 2019, au groupe chinois Sinomine Resources. Le gisement s’étend sur 1 520 m de long, 1 060 m de large et sur une épaisseur de plus de 100 m. La masse totale de pegmatite est de 57,4 millions de t renfermant :
- 23,6 % de césium,
- 2,9 % de rubidium,
- 1,4 % de lithium,
- plus de 0,1 % de tantale.
Des exploitations fonctionnent également, avec une coproduction de césium et de rubidium lors de l’exploitation de mines de lithium, à Bikita, au Zimbabwe et dans le désert de Karibib, en Namibie.
Fabrication industrielle
Coproduit avec le lithium et le césium, la récupération du rubidium qui possède des propriétés physiques et chimiques proches de ces éléments demande une succession d’opérations. Après dissolution dans l’acide sulfurique des minerais de pollucite ou de lépidolite, on obtient un alun complexe des différents éléments alcalins contenus, sous forme de sulfate complexe avec l’aluminium. Une suite de cristallisations fractionnées, jusqu’à plus de 30 pour obtenir le rubidium pur, donne de l’alun de rubidium, Rb2SO4,Al(SO4)3,24H2O. Ce dernier, en milieu alcalin donne un précipité d’hydroxyde de rubidium qui est ainsi séparé des ions aluminium restant en solution sous forme d’ions aluminates.
Productions
La production mondiale est estimée à moins de 5 t/an.
Principal producteur
Le principal producteur était la société Tantalum Mining Corporation (Tanco), filiale de Cabot, qui exploitait la mine de Bernic Lake. Fin 2015, celle-ci a cessé l’exploitation minière, les stocks accumulés étant suffisants pour poursuivre la production. Fin juin 2019, cette activité de Cabot a été vendue au groupe chinois Sinomine Resources.
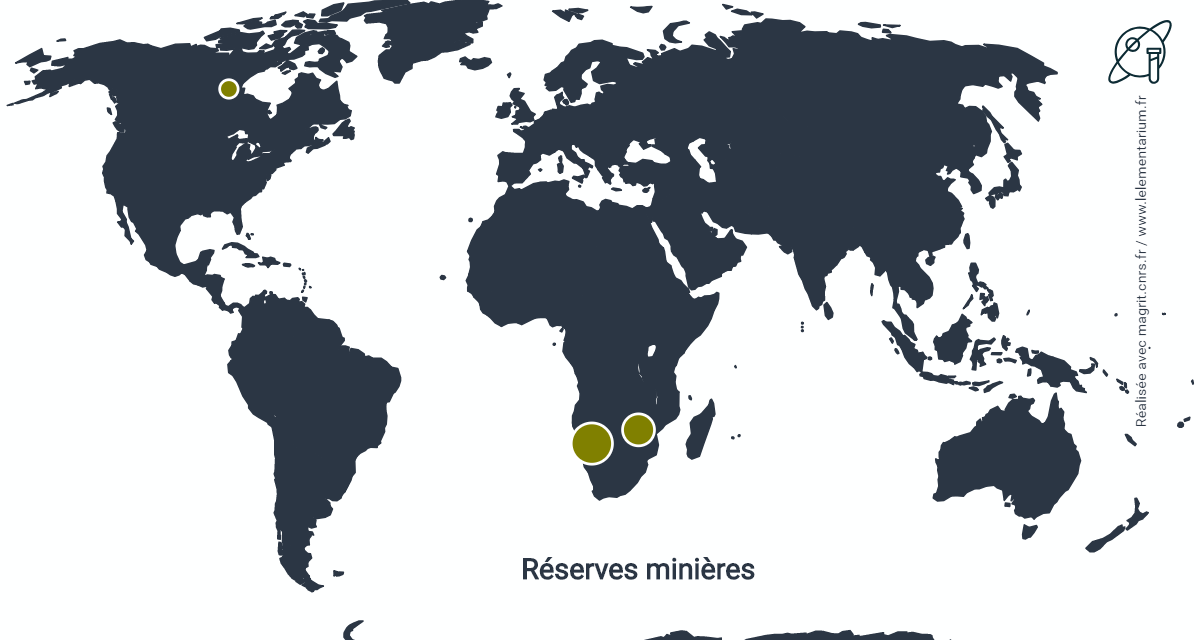
Réserves minières
Les réserves minières sont estimées à partir des réserves connues de pollucite et lépidolite. Évaluées à 100 000 t de Rb2O elles sont réparties dans les pays suivants :
| Namibie | 50 000 t | Zimbabwe | 30 000 t | |
| Canada | 12 000 t |
Source : USGS
Utilisations
Consommation
Elle est estimée, dans le monde, à quelques tonnes par an.
Secteurs d’utilisation
Les principales utilisation sont dans des verres spéciaux pour des fibres optiques destinées aux télécommunications. Le rubidium introduit lors de la fabrication du verre sous forme de carbonate réduit la conductibilité électrique du verre et augmente sa stabilité et sa durabilité.
Utilisations diverses
Ce sont les mêmes que le césium, les deux éléments étant interchangeables. Voir le chapitre césium.
Bibliographie
- W. C. Butterman and R.G. Reese Jr., « Rubidium« , Open-file report 03-045, Mineral Commodity Profiles, USGS, 2003.