Le cumène est synthétisé à partir du benzène et du propylène et sert quasi exclusivement à préparer le phénol et l’acétone par oxydation à l’air qui donne l’hydroperoxyde de cumyle puis par cission formant simultanément le phénol et l’acétone. Le phénol et l’acétone sont employés pour préparer le bisphénol A obtenu avec 2 moles de phénol pour une mole d’acétone utilisé pour produire des polycarbonates. Le phénol donne aussi des résines phénoliques, du caprolactame, de l’acide adipique alors que l’acétone est utilisé comme solvant, pour élaborer le méthacrylate de méthyle destiné à la polymérisation, pour donner de l’isopropanol.
Données physico-chimiques
Cumène
Données atomiques
| Formule | Géométrie | Masse molaire | Moment dipolaire |
| C9H12 | 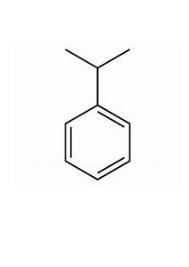 |
120,195 g.mol-1 | 0,79 D |
Données physiques
| Masse volumique | Température de fusion | Température d’ébullition | Température critique | Pression critique | Limites d’explosivité dans l’air, en volume | Température d’autoinflammation | Solubilité dans l’eau |
| 0,862 g.cm-3 | -96°C | 152,4°C | 357,9°C | 3 210 kPa | 0,9 % – 6,5 % | 424°C | 50 mg.L-1 |
Phénol
Données atomiques
| Formule | Géométrie | Masse molaire | Moment dipolaire |
| C6H6O | 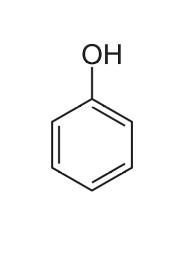 |
94,113 g.mol-1 | 1,224 D |
Données physiques
| Masse volumique | Température de fusion | Température d’ébullition | Température critique | Pression critique | Limites d’explosivité dans l’air, en volume | Température d’autoinflammation | Solubilité dans l’eau |
| 1,073 g.cm-3 | 43°C | 182°C | 421°C | 6 130 kPa | 1,36 % – 10 % | 715°C | 8,3/100mL à 20°C |
Acétone
Données atomiques
| Formule | Géométrie | Masse molaire | Moment dipolaire |
| C3H6O | 58,08 g.mol-1 | 2,88 D |
Données physiques
| Masse volumique | Température de fusion | Température d’ébullition | Température critique | Pression critique | Limites d’explosivité dans l’air, en volume | Température d’autoinflammation | Solubilité dans l’eau |
| 0,7845 g.cm-3, à 25°C |
-94,6°C | 56,05°C | 235°C | 4 701 kPa | 2,15 % – 13 % | 465°C | miscible |
Données industrielles
Le cumène (ou isopropylbenzène) est un dérivé du benzène. C’est un intermédiaire qui sert presque exclusivement (à 98 %) à fabriquer du phénol et de l’acétone. Possédant un indice d’octane élevé, il peut être employé comme adjuvant au carburant pour l’aviation afin de remplacer le benzène. Il peut également servir comme diluant de peintures.
Le phénol (ou hydroxybenzène) et l’acétone (2-propanone ou diméthyl cétone) sont des composés de grande importance. Bien que le phénol puisse être extrait des goudrons ou des eaux résiduaires des unités de craquage, ils sont produits en majeure partie par synthèse et le procédé utilisant le cumène comme intermédiaire est utilisé à plus de 98 %. Il fût découvert en 1944 par Hock et Lang et il est exploité depuis les années 50. Le procédé au cumène représente 90,6 % des capacités de production de l’acétone, la déshydrogénation de l’isopropanol, 1,2 %, d’autres procédés comptant pour 8,2 %.
Fabrication industrielle
Synthèse du cumène :
Le procédé UOP (Union Oil Products) est le plus utilisé pour synthétiser le cumène à partir du benzène et du propylène (ou propène). La réaction de synthèse est représentée ci-dessous :
![]()
Les conditions opératoires sont les suivantes : 34 bar de pression et une température de 190°C à l’entrée du réacteur (la réaction étant exothermique (ΔrH° = – 113 kJ/mol) le mélange sort à 250°C). La réaction a lieu en phase liquide en présence, principalement, de zéolithe comme catalyseur. On sépare le cumène des sous-produits par distillation. Parmi les sous-produits, les diisopropylbenzènes (C3H7-C6H4-C3H7), le nonène (C9H18) et l’hexène (C6H12) sont séparés pour être valorisés, le propane et les produits lourds sont incinérés. Le rendement est de 90 % par rapport au propène et de 97 % par rapport au benzène.
Les zéolithes représentent, en 2013, environ 80 % des catalyseurs employés, l’acide phosphorique 15 % et le chlorure d’aluminium 5 %.
La synthèse du cumène représente 20 % de la consommation du benzène et 4 % de celle du propylène.
Synthèse du phénol et de l’acétone :
On ne décrira que le procédé au cumène pour lequel 1 tonne de cumène donne au plus 0,78 tonne de phénol. Cette synthèse, dont le rendement est de 90 %, a lieu en deux étapes indépendantes :
La première consiste à oxyder le cumène par de l’air, à une température comprise entre 90°C et 130°C, sous une pression de 5 à 10 bar en phase liquide et à un pH d’environ 9,5 pour éviter que la réaction de cission ait lieu dans le même réacteur. La réaction est exothermique (ΔrH° = – 117 kJ/mol). Elle aboutit à la formation d’hydroperoxyde de cumyle :
![]()
Par distillation et entraînement à la vapeur, on obtient l’hydroperoxyde de cumyle à 80 %. Le taux de conversion est de 40 %.
La seconde est la cission de l’hydroperoxyde de cumyle en phénol et acétone suivant la réaction exothermique (ΔrH° = – 252 kJ/mol) suivante :
![]()
Cette réaction a lieu à 50°C en présence d’acide sulfurique (0,1 à 2 %), puis le mélange est ensuite neutralisé par du phénolate de sodium et distillé (procédé Phenol Chemie). On peut également travailler à 60°C sous pression en présence d’acide sulfurique en solution dans le phénol (procédé Rhône-Poulenc) ou dans l’acétone (procédé Hercule). On obtient des sous-produits valorisables, en particulier de l’acétophénone et de l’alpha-méthylstyrène ; dus à des réactions secondaires, mais surtout 0,6 tonne d’acétone par tonne de phénol.
Bilan matière :
0,872 t de benzène et 0,470 t de propylène donnent 1,310 t de cumène qui donne à son tour 1 t de phénol et 0,612 t d’acétone.
Productions
Cumène : les capacités mondiales de production, en 2018, sont de 17,59 millions de t/an.
En 2015, la capacité de l’Europe de l’Ouest y compris Norvège et Turquie est de 3,580 millions de t/an.
En 2019, la production de l’Union européenne est de 1,887 million de t dont 738 803 t en Allemagne.
Commerce international : en 2019.
Principaux pays exportateurs sur un total de 1,542 million de t en 2018.
| Pays Bas | 468 | Belgique | 73 | |
| Singapour | 418 | Russie | 48 | |
| Japon | 330 | Taipei chinois | 26 | |
| États-Unis | 116 | Corée du Sud | 10 |
Source : ITC
Les exportations des Pays Bas sont destinées à 80 % à la Belgique, 20 % à l’Allemagne.
Principaux pays importateurs sur un total de 1,732 million de t.
| Belgique | 699 | Italie | 71 | |
| Chine | 649 | États-Unis | 63 | |
| Allemagne | 113 | Inde, en 2018 | 27 | |
| Taipei chinois | 77 | Corée du Sud | 17 |
Source : ITC
Les importations belges proviennent à 59 % des Pays Bas, 15 % des États-Unis, 14 % d’Espagne, 7 % du Japon.
Phénol : les capacités mondiales de production, en 2018, sont de 13,850 millions de t/an.
En 2016, la capacité de production chinoise est de 2,51 millions de t/an, en 2018, la capacité de production de la Corée du Sud est de 1,28 million de t/an, celle de Taipei chinois de 1,08 million de t/an, celle de la Thaïlande de 470 000 t/an.
En 2015, la production mondiale a été de 11,4 millions de t.
En 2019, la production de l’Union européenne est de 2,378 millions de t dont 954 166 t en Allemagne. En 2018, la production de la Corée du Sud est de 1,338 million de t, celle de Taipei chinois de 1,034 million de t, celle du Japon de 587 400 t, celle de la Thaïlande de 552 000 t.
Commerce international : en 2019.
Principaux pays exportateurs sur un total de 1,766 million de t en 2018.
| Corée du Sud | 323 | Finlande | 140 | |
| États-Unis | 225 | Pays Bas | 101 | |
| Arabie Saoudite, en 2018 | 205 | Singapour | 97 | |
| Thaïlande | 197 | Taipei chinois | 60 |
Source ITC
Les exportations coréennes sont destinées à 37 % à la Chine, 31 % à Taipei chinois, 27 % au Japon.
Principaux pays importateurs sur un total de 2,456 millions de t.
| Chine | 468 | Taipei chinois | 165 | |
| Pays Bas | 333 | Pologne | 100 | |
| Allemagne | 269 | Japon | 90 | |
| Inde, en 2018 | 259 | Corée du Sud | 62 |
Source ITC
Les importations chinoises proviennent à 35 % d’Arabie Saoudite, 25 % de Corée du Sud, 13 % de Thaïlande.
Acétone : les capacités mondiales de production, en 2018, sont de 9,0 millions de t/an. Répartition, en 2017 :
| Asie-Pacifique | 46 % | Amérique du Nord | 21 % | |
| Europe | 26 % |
Source : BerOe
En 2016, la capacité de production chinoise est de 1,52 million de t/an.
En 2015, la production mondiale a été de 7,8 millions de t.
En 2019, la production de l’Union européenne est de 1,427 million de t dont 433 501 t en Allemagne, 329 773 t en Espagne, 140 850 t en Italie, 28 917 t en Pologne.
Commerce international : en 2019.
Principaux pays exportateurs sur un total de 1,585 million de t, en 2018.
| Taipei chinois | 242 | Singapour | 153 | |
| Corée du Sud | 220 | Allemagne | 118 | |
| Thaïlande | 200 | États-Unis | 115 | |
| Arabie Saoudite, en 2018 | 160 | Afrique du Sud | 75 |
Source : ITC
Les exportations de Taipei chinois sont destinées à 83 % à la Chine.
Principaux pays importateurs sur un total de 2,087 millions de t en 2018.
| Chine | 779 | Inde, en 2018 | 123 | |
| Allemagne | 155 | Royaume Uni | 109 | |
| Pays Bas | 129 | Mexique, en 2018 | 85 | |
| États-Unis | 124 | Italie | 73 |
Source : ITC
Les importations chinoises proviennent à 25 % de Taipei chinois, 23 % de Corée du Sud, 21 % d’Arabie Saoudite, 20 % de Thaïlande.
Principaux producteurs : d’après leurs capacités annuelles de production de phénol, en 2018.
| Ineos Phenol (Royaume Uni) | 1 870 | LG Chem (Corée du Sud) | 600 | |
| Mitsui (Japon) | 815 | Sinopec (Chine) | 550 | |
| CEPSA (Espagne) | 790 | Kumho P&B (Corée du Sud) | 550 | |
| FCFC (Taipei chinois) | 700 | AdvanSix (États-Unis) | 500 | |
| Sabic (Arabie Saoudite) | 640 | PTT, (Thaïlande) | 492 | |
| Chang Chun Plastics (Taipei chinois) | 600 | Shell (États-Unis) | 360 |
Sources : rapports des sociétés et Nexant
- La société Ineos (Royaume Uni) a fait l’acquisition de Phenol Chemie (groupe Degussa) en 2001 pour devenir Ineos Phenol, premier producteur mondial de phénol et d’acétone. Par ailleurs, a acquis, en octobre 2015, la branche aromatiques de Axiall avec une capacité de production de 900 000 t/an de cumène à Pasadena, au Texas. Ineos Phenol possède 5 sites de production : Mobile (Alabama, États-Unis) avec 540 000 t/an de phénol et 280 000 t/an d’acétone, Pasadena (Texas, États-Unis) avec 907 000 t/an de cumène, Gladbeck (Allemagne) avec 650 000 t/an de phénol et 400 000 t/an d’acétone, Marl (Allemagne) avec 260 000 t/an de cumène et Anvers (Belgique) avec 680 000 t/an de phénol et 480 000 t/an d’acétone. La capacité totale de production de cumène est de 1,167 million de t/an et celle d’acétone de 1,160 million de t/an. La capacité de production à Mobile doit être portée à 850 000 t/an de phénol et celle de Marl à 750 000 t/an de cumène pour 2021.
- Mitsui (Japon), possède deux usines au Japon, une dans la province d’Osaka avec 200 000 t/an de phénol et 120 000 t/an d’acétone et une dans la province de Chiba avec 190 000 t/an de phénol et 114 000 t/an d’acétone, une usine à Singapour, avec 300 000 t/an de phénol et 180 000 t/an d’acétone et une usine, en Chine, à Shanghai, en joint venture avec Sinopec, d’une capacité de 250 000 t/an de phénol et 150 000 t/an d’acétone. La capacité totale de production de cumène est de 1,18 million de t/an.
- CEPSA, détenu par le groupe d’Abu Dhabi Mubadala Invesment Company, possède à Palos de la Frontera, dans la province de Huelva, en Espagne, des capacités de production de 1 million de t/an de cumène, 600 000 t/an de phénol et 370 000 t/an d’acétone. A Shanghai, en Chine, possède à 75 % avec 25 % à Sumitomo, des capacités de production de 360 000 t/an de cumène, 250 000 t/an de phénol et 150 000 t/an d’acétone.
- FCFC (Formosa Chemicals & Fibre Corp., Taipei chinois), exploite, à Taipei chinois, une usine à Mailiao, avec des capacités de 540 000 t/an de cumène, 400 000 t/an de phénol et 246 000 t/an d’acétone et à Ningbo, en Chine, une capacité de production de 450 000 t/an de cumène, 300 000 t/an de phénol et 180 000 t/an d’acétone.
- Sabic exploite, aux États-Unis, une usine à Mount Vernon dans l’Indiana, avec 350 000 t/an de phénol et 208 000 t/an d’acétone, une usine à Jubail, en Arabie Saoudite, avec 290 000 t/an de cumène, 220 000 t/an de phénol et 135 000 t/an d’acétone, une usine, en joint venture 50/50 avec Sinopec, à Binhai, province de Tianjin, en Chine, avec 220 000 t/an de phénol et 130 000 t/an d’acétone.
- LG Chem produit, Corée du Sud, à Yeosu et Daesan, 805 000 t/an de cumène, 600 000 t/an de phénol et 355 000 t/an d’acétone.
- Sinopec, produit, en Chine au travers de diverses joint-ventures avec Mitsui, à Shanghai, avec CEPSA, à Shanghai, avec Sabic à Binhai, province de Tianjin, avec FCFC à Ningbo ainsi qu’en propre, à Caojing avec 135 000 t/an de phénol et 85 000 t/an d’acétone.
- Kumho P&B, joint venture entre Kumho Petrochemical à 78,2 % et Nippon Steel Chemical, possède une capacité de production, à Yeosu, en Corée du Sud, de 900 000 t/an de cumène, 680 000 t/an de phénol et 420 000 t/an d’acétone.
- AdvanSix société issue de Honeywell, exploite, aux États-Unis, une usine à Frankford, en Pennsylvanie, avec une capacité de production de 500 000 t/an de phénol et 308 000 t/an d’acétone. Le phénol produit est destiné, à 80 %, à produire du caprolactame.
- PTT produit en Thaïlande 492 000 t/an de phénol et 304 000 t/an d’acétone.
- Altivia (Etats-Unis), a acquis, en novembre 2015, aux États-Unis, l’usine de Haverhill, dans l’Ohio, à la société Haverhill Chemicals, avec une capacité de production de 300 000 t/an de phénol et 173 000 t/an d’acétone.
- Shell qui exploitait une usine, aux États-Unis, à Deer Park, au Texas, avec une capacité de production de 725 000 t/an de cumène, de 600 000 t/an de phénol et 366 000 t/an d’acétone a fermé, en 2018, l’une de ses 3 lignes de production soit une capacité de 240 000 t/an.
- Versalis (ENI, Italie), produit du cumène à Priolo, en Italie, avec 320 000 t/an et de l’acétone et du phénol, à Mantoue, avec 300 000 t/an de phénol et 185 000 t/an d’acétone.
- Olin a acquis, en octobre 2015, les activités de Dow Chemical dans la chlorochimie et les résines époxy avec aux Pays Bas, à Terneuzen, une usine de production de cumène de 700 000 t/an et aux États-Unis, une usine à Freeport, au Texas, de 295 000 t/an de phénol et 180 000 t/an d’acétone.
Situation française
En 2019.
Seqens (ex Novacap) a repris les activités du groupe Rhodia dans ce domaine et est le seul producteur français dans son usine de Roussillon (38) avec une capacité de production de 260 000 t/an de cumène, 185 000 t/an de phénol et 114 000 t/an d’acétone.
Cumène :
- Exportations : confidentielles.
- Importations : 10 902 t à 79 % d’Espagne, 19 % d’Allemagne.
Phénol :
- Exportations : confidentielles.
- Importations : 13 460 t à 37 % de Belgique, 30 % d’Espagne, 18 % d’Allemagne, 13 % de Finlande.
Acétone :
- Exportations : 28 677 t à 55 % vers l’Italie, 18 % l’Espagne, 12 % la Suisse, 11 % l’Allemagne.
- Importations : 47 318 t à 33 % d’Arabie Saoudite, 17 % d’Allemagne, 15 % d’Espagne, 9 % d’Italie.
Utilisations
Consommations
Cumène : 13,1 millions de t, en 2012, dans le monde. Répartition de la consommation :
| Asie du Nord-Est (Chine, Japon, Taipei chinois et Corée du Sud) | 39 % | Europe de l’Ouest | 23 % | |
| Amérique du Nord | 24 % |
Source : Rajeev M. Pandia
Phénol : 10,6 millions de t, en 2015, dans le monde. En 2012 :
| Asie-Pacifique | 4 120 | États-Unis | 2 632 | |
| Europe | 2 899 |
Source : Rajeev M. Pandia
En 2014, la consommation chinoise est de 1,573 million de t.
Acétone : 6,55 millions de t, en 2017, dans le monde. Répartition, en 2015 :
| Chine | 23 % | Europe de l’Ouest | 20 % | |
| États-Unis | 21 % |
Source : IHS Markit
Secteurs d’utilisation
Cumène : à 98 % pour produire du phénol et de l’acétone.
Phénol : dans le monde, en 2015.
| Bisphénol A | 49 % | Caprolactame | 7 % | |
| Résines phénoliques | 30 % | Acide adipique | 2 % | |
| Alkyl phénol | 8 % |
Source : ICIS
Le bisphénol A est produit par réaction entre deux moles de phénol et une mole d’acétone.
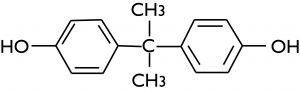
Il est utilisé comme monomère pour obtenir le polycarbonate et comme agent durcisseur des résines époxydes utilisées comme revêtements de boîtes de conserve, de canettes… Depuis le 1er janvier 2015, cet usage comme revêtement de boîtes est suspendu en France. La consommation de polycarbonate, en 2018, est de 4,4 millions de t, celle de résines époxydes de 2,6 millions de t.
Les résines phénoliques sont élaborées par réaction entre le phénol et le formaldéhyde. Elles sont utilisées, par exemple, dans la fabrication du contre-plaqué. La Bakélite est une résine phénolique qui fut la première résine synthétique commercialisée.
Le caprolactame ((CH2)5C(O)NH) est un intermédiaire de la synthèse du nylon 6. Il est obtenu à partir de la cyclohexanone ((CH2)5CO) provenant elle-même, en partie, de l’hydrogénation partielle du phénol :
C6H5OH + 2 H2 = (CH2)5CO
L’utilisation en chimie fine regroupe de nombreux produits, qui ne sont pas synthétisés en grande quantité, mais sont d’une grande importance : acide salicylique pour la synthèse de l’aspirine, acétylparaaminophénol pour le paracétamol, chlorophénols pour les herbicides, hydroquinone et ses dérivés pour l’alimentation.
Acétone : dans le monde, en 2019.
| Solvant | 33 % | Méthylisobutylcétone | 7 % | |
| Bisphénol A | 28 % | Isopropanol | 6 % | |
| Méthacrylate de méthyle | 25 % |
Source : Merchant Research & Consulting
Le méthacrylate de méthyle (MMA, CH2=C(CH3)CO2CH3) est le monomère du polyméthacrylate de méthyle (PMMA). Il est obtenu à partir d’acétone et de cyanure d’hydrogène en passant par la cyanohydrine d’acétone.
La méthylisobutylcétone (MIBK) est principalement utilisée dans la dilution des résines époxydes, vinyliques et acryliques.
L’alcool isopropylique (ou isopropanol) peut être préparé à partir d’acétone, le procédé classique étant à partir du propylène. Novapex a ainsi construit, en France, une unité de production à Roussillon (38), à partir d’acétone, d’une capacité de 40 000 t/an, selon un procédé développé par Mitsui.
Toxicité
Phénol :
Le phénol est rapidement absorbé lors de son introduction dans l’organisme. L’absorption est estimée à 70 à 80 % en 6 heures pour une exposition à des vapeurs de phénol à des concentrations comprises entre 1,6 à 5,2 ppm. Le phénol est ensuite rapidement distribué dans tous les tissus, les organes cibles sont le cerveau et les reins.
Les effets locaux rapportés sont des érythèmes ou des dépigmentations cutanées et, dans les cas les plus sévères, des corrosions pouvant même atteindre le stade de nécrose.
Le phénol est classé par l’Union Européenne comme mutagène catégorie 3 : substance préoccupante pour l’homme en raison d’effets mutagènes.
En France, le ministère du travail a fixé à 5 ppm, soit 19 mg/m3, la valeur limite moyenne d’exposition (VME).
Bisphénol A :
Le bisphénol A est un perturbateur endocrinien qui a des effets sur la reproduction, le métabolisme et des pathologies cardiovasculaires. Il est classé reprotoxique de catégorie 3. Ces effets sont avérés sur l’animal et suspectés chez l’homme. Sa principale voie d’introduction dans l’organisme est la voie alimentaire, à partir d’aliments contenus dans des matériaux en polycarbonate ou revêtus de résines époxydes. Ces effets pourraient être observés même à de faibles niveaux d’exposition, au cours des phases sensibles du développement de l’individu (femmes enceintes, nourrissons, jeunes enfants).
Pour cette raison, il est interdit dans les biberons, en France, depuis le 23 juin 2010.
En France, la loi du 24 décembre 2012, a suspendu, a compter du 1er janvier 2013, l’utilisation du bisphénol A dans tous les conditionnements, contenants et ustensiles destinés à entrer en contact direct avec des denrées alimentaires pour les nourrissons et enfants en bas âge.
Cette suspension a pris effet le 1er janvier 2015 pour tout autre conditionnement, contenant ou ustensile comportant du bisphénol A et destiné à entrer en contact direct avec des denrées alimentaires.
Bibliographie