L’élément iode se présente dans la nature sous la forme d’ions iodate (IO3–) dans le minerai de caliche exploité au Chili ou dans des saumures extraites lors de l’exploitation de puits de pétrole ou de gaz naturel, au Japon et aux États-Unis. Le corps simple est le diiode (I2).
Le diiode est un solide à température et pression ambiantes. Dissout dans l’alcool c’est un excellent désinfectant. Son utilisation principale est toutefois comme agent de contraste pour les scanners médicaux.
Plongé dans de l’eau contenant des ions iodure (I–), le diiode forme des ions I3– qui se colorent en bleu au contact de l’amidon. Cela permet de détecter les faux billets, imprimés sur du papier classique contenant de l’amidon.
Données physico-chimiques
Données atomiques
| Formule | Masse molaire | Distance interatomique | Structure cristalline |
| I2 | 253,809 g.mol-1 | 266,6 pm | orthorhombique de paramètres a = 0,7265 nm, b = 0,4786 nm et c= 0,9791 nm |
Données physiques
| Masse volumique | Température de fusion | Température d’ébullition | Température critique | Pression critique | Température point triple | Pression point triple | Conductibilité électrique | Conductibilité thermique | Solubilité dans l’eau |
| 4,93 g.cm-3 | 113,5°C | 184,35°C | 546°C | 11 700 kPa | 113°C | 12,1 kPa | 8,0.10-8 S.m-1 | 0,0449 W.m-1K-1 |
|
Données chimiques
| pKa : I+aq/HIO | pKa : HIO/IO– | pKa : HIO3/IO3– | pKa : H5IO6/H4IO6– | pKa : H4IO6–/H3IO62- | pKa : H3IO62-/H2IO63- |
| 4,51 | 10,6 | 0,8 | 3 | 6,7 | 14 |
Potentiels standards :
| H5IO6 + H+ + 2e = IO3– + 3H2O | E° = 1,6 V |
| 2IO3– + 12H+ + 10e = I2(s) + 6H2O | E° = 1,19 V |
| IO3– + 3H2O + 6e = I– + 6OH– | E° = 0,26 V |
| IO– + H2O + 2e = I– + 2OH– | E° = 0,49 V |
| HIO + H+ + 2e = I– + H2O | E° = 0,99 V |
| I2(s) + 2e = 2I– | E° = 0,535 V |
| I3– + 2e = 3I– | E° = 0,555 V |
Données thermodynamiques
Diiode cristallisé :
Diiode gazeux :
|
Diiode en solution aqueuse :
|
Données industrielles
L’iode se présente dans la nature sous la forme d’ions iodure (I–) ou iodate (IO3–). Le corps simple est le diiode (I2).
État naturel
La teneur de l’écorce terrestre est de 0,4 ppm d’iode, celle de l’eau de mer est de 0,06 ppm. L’eau de mer représente 90 milliards de t de ressources, celles-ci n’étant pas actuellement économiquement exploitables.
Des émissions dans l’atmosphère de iodométhane (CH3I), estimées à 214 000 t/an, proviennent d’algues et de rizières.
L’iode a été récupérée pendant longtemps et jusqu’à la fin des années 1950, à partir d’algues de la famille des laminaires qui peuvent extraire l’iode de l’eau de mer et la concentrer jusqu’à une teneur de 0,45 % de leur poids sec. Cette source, encore exploitée en Chine comme co-production d’alginate de sodium, ne représente plus que 2 % de la production mondiale.
La production de diiode provient actuellement de deux sources principales :
- Le minerai de caliche, roche sédimentaire riche (de 6 à 7 %) en ions nitrate, NO3–, avec de faibles quantités d’iode, de 400 à 500 ppm, principalement sous forme de lautarite, iodate de calcium (Ca(IO3)2), présent exclusivement au Chili, dans le désert d’Atacama. Les gisements se présentent sous forme de veines de 20 cm à 5 mètres d’épaisseur sous une couche de stérile de 50 cm à 1,5 mètre.
- Des saumures extraites lors de l’exploitation de puits de pétrole ou de gaz naturel. Cette source est exploitée principalement au Japon et aux États-Unis. Ces saumures ont des teneurs comprises entre 100 et 400 ppm d’iode. Dans le cas des saumures japonaises, leur concentration en chlorure de sodium est identique à celle de l’eau de mer mais par contre, leur teneur en iode est 2 000 fois plus élevée.
- Quelques pays, Turkménistan, Azerbaïdjan et Indonésie, exploitent directement des saumures extraites de puits, cette production n’étant pas associée à celle d’hydrocarbures.
Traitement du minerai et des saumures
Caliche :
Le minerai, après concassage, est traité par lixiviation avec de l’eau, en tas ou en usine. La difficulté d’exploitation du minerai chilien réside dans sa localisation dans un désert avec des difficultés d’approvisionnement en eau. Une société utilise de l’eau de mer acheminée par une canalisation de 75 km de longueur. Les taux de récupération de l’iode varie de 60 % pour la lixiviation en tas à 90 % pour celle réalisée, en usine, par agitation dans des cuves.
Par exemple, à Aguas Blancas, la lixiviation en tas est réalisée sur une surface de 25 000 à 30 000 m2, avec des tas de 450 000 t de minerai sur une hauteur de 10 m. La solution de lixiviation qui est recyclée après extraction de l’iode et éventuellement du nitrate et du sulfate de sodium, percole au travers des tas de minerais avec un débit de 1,75 L/m2/h, avec de multiples recyclages, jusqu’à ce que sa concentration atteigne 0,2 g d’iode/L, cela peut prendre jusqu’à 15 mois. Une telle lixiviation en tas est effectuée dans la mine de Nueva Victoria. Dans ces exploitations, le diiode est d’abord extrait puis les solutions sont concentrées par évaporation solaire avant d’en extraire le nitrate de sodium.
A Pedro de Valdivia, le minerai subit une lixiviation en usine avec une première opération qui consiste à récupérer le nitrate de sodium contenu dans le minerai. En usine, la solution de lixiviation, saturée en chlorure et sulfate de sodium et qui titre de 320 à 340 g/L de nitrate de sodium, est chauffée à 40-45°C. En quelques jours, en présence du minerai, elle s’enrichit en nitrate de sodium qui voit sa concentration passer à 440-480 g/L. Par refroidissement à 10-15°C, le nitrate de sodium cristallise et est récupéré par centrifugation.
La solution, qui renferme de 1 à 2 g/L d’iode, sous forme d’ions iodate, est destinée à une deuxième opération de récupération de l’iode.
Dans une colonne, l’injection de dioxyde de soufre réduit les ions iodate en diiode selon la réaction suivante :
2 IO3– + 5 SO2 + 4 H2O = I2 + 5 SO42- + 8 H+
Le diiode formé est récupéré par flottation et par extraction à l’aide de kérosène ou par entraînement par soufflage d’air, le diiode étant peu soluble dans l’eau et se sublimant facilement. Dans ce dernier cas, le diiode gazeux barbote dans une solution d’hydrogénosulfite de sodium où il est réduit en ion iodure selon la réaction suivante :
I2 + HSO3– + H2O = 2 I– + SO42- + 3 H+
Le diiode est obtenu par oxydation, à l’aide de dichlore, selon la réaction suivante :
2 I– + Cl2 = I2 + 2Cl–
La solution dont ont été extraits le nitrate de sodium et l’iode, retourne à la lixiviation.
Saumures :
Une première séparation a lieu entre le pétrole ou le gaz naturel, les impuretés solides et la saumure. Cette dernière est ensuite traitée selon deux procédés :
L’un, proche de celui utilisé pour le minerai chilien, consiste à réduire les ions iodate en diiode qui est entraîné par soufflage d’air, absorbé dans une solution aqueuse d’acide iodhydrique et d’acide sulfurique, réduit en ions iodure par du dioxyde de soufre, puis enfin oxydé en diiode à l’aide de dichlore.
L’autre utilise des résines échangeuses d’ions ou du charbon actif qui fixent l’iode obtenue préalablement par oxydation des ions iodate de la saumure à l’aide de dichlore. L’iode est ensuite élué à l’aide d’hydroxyde de sodium pour donner, par dismutation, des ions iodure et iodate selon la réaction :
3 I2 + 6 OH– = IO3– + 5 I– + 3 H2O
L’ajout d’acide sulfurique permet, par médiamutation, de former du diiode selon la réaction :
IO3– + 5 I– + 6 H+ = 3 I2 + 3 H2O
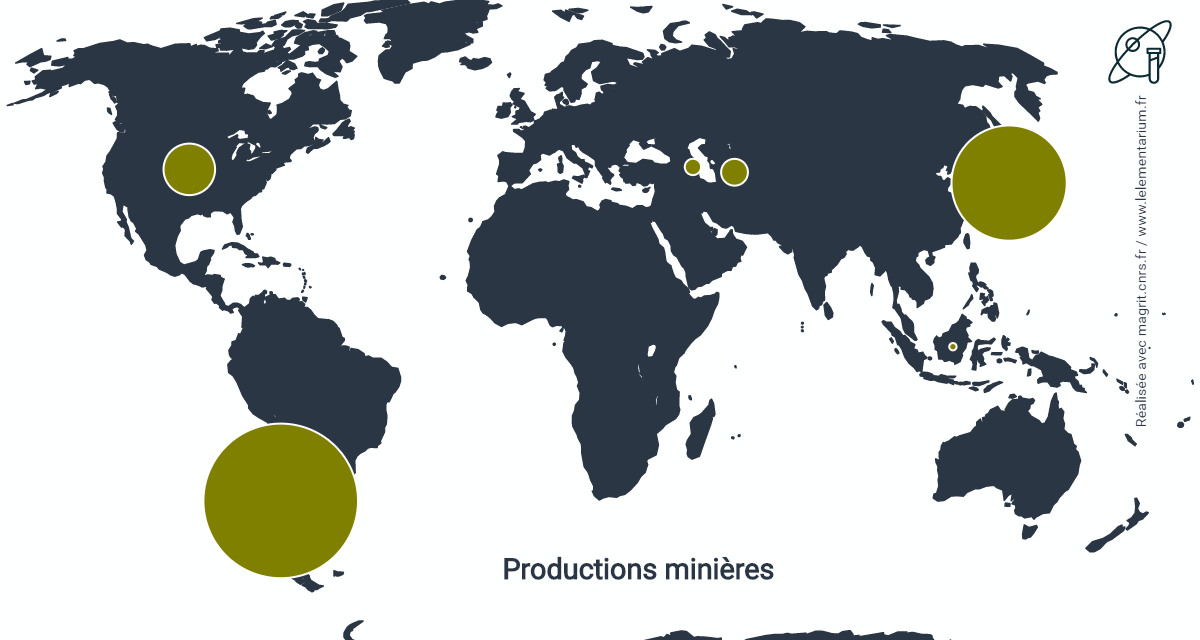
Productions minières
En 2019. Monde : 30 000 t.
| Chili | 18 000 t | Turkménistan | 600 t | |
| Japon | 9 000 t | Azerbaïdjan | 200 t | |
| États-Unis (estimation) | 2 000 t | Indonésie | 40 t |
Sources : USGS et Cochilco
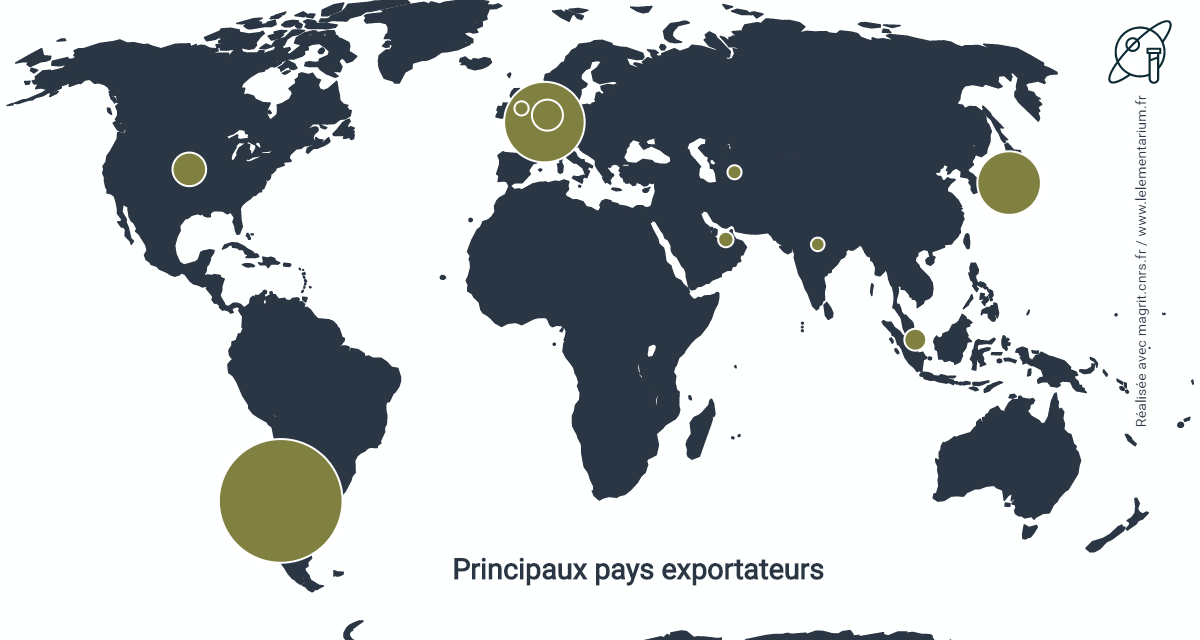
Commerce international : en 2019.
Principaux pays exportateurs sur un total de 36 139 t :
| Chili | 21 135 | Inde | 352 | |
| Belgique | 5 093 | Singapour | 275 | |
| Japon | 5 014 | Royaume Uni | 253 | |
| États-Unis | 1 480 | Corée du Sud | 250 | |
| Pays Bas | 1 037 | Azerbaïdjan | 192 |
Source : ITC
Les exportations chiliennes sont destinées à 24 % à la Chine, 22 % à la Belgique, 19 % aux États-Unis, 11 % à l’Inde.
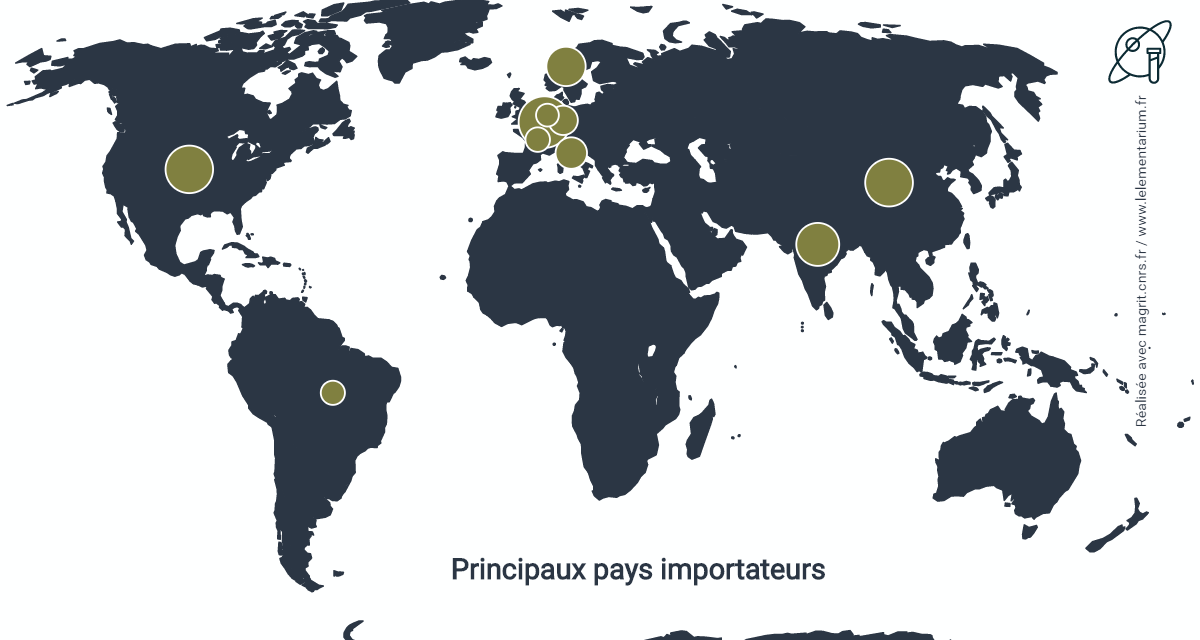
Principaux pays importateurs :
| Chine | 6 764 | Allemagne | 1 905 | |
| Belgique | 4 865 | Brésil | 1 252 | |
| États-Unis | 4 304 | France | 1 164 | |
| Norvège | 3 705 | Royaume Uni | 842 | |
| Italie | 1 974 | Canada | 596 |
Source : ITC
Les importations chinoises proviennent à 83 % du Chili, 12 % du Japon, 3 % d’Iran.
Principaux producteurs :
Au Chili, qui représentent, en 2019, 59 % des ventes mondiales.
- La Sociedad Quimica y Minera de Chile (SQM) est le n°1 mondial avec une part de marché de 34 % et une production, en 2019, de 12 082 t de diiode dont 9 558 t à Nueva Victoria, pour une capacité totale de production de 14 800 t/an. Elle possède deux exploitation minière en activité dans le nord du Chili : Nueva Victoria, avec 10 000 t/an et Pedro de Valdivia. A Nueva Victoria, les réserves prouvées sont de 324,7 millions de t de minerai renfermant 5,5 % de nitrates et 445 ppm d’iode et les réserves probables de 984,7 millions de t renfermant 5,2 % de nitrates et 421 pppm d’iode. A Pedro de Valdivia, les réserves prouvées sont de 91,9 millions de t de minerai renfermant 6,9 % de nitrates et 424 ppm d’iode et les réserves probables de 240,9 millions de t renfermant 6,2 % de nitrates et 414 pppm d’iode
SQM, en association avec la société américaine Ajay, a créé une joint-venture, Ajay-SQM, qui produit, au Chili, à Santiago, aux États-Unis, à Powder Springs, en Géorgie et en France, à Evron (53), divers composés chimique de l’iode, sous la marque Iodeal. - Compania de Salitre y Yodo (Cosayach), société du groupe familial Errázuriz, avec une capacité de production de 200 000 t/an de nitrate de potassium, 120 000 t/an de nitrate de sodium et 6 000 t/an de diiode dans 3 exploitations :
- Negreiros, 40 % de la production.
- Soledad, 40 % de la production.
- Cali Cali, 20 % de la production.
Actuellement, la capacité de production est réduite à 2 500 t/an du fait des difficultés d’approvisionnement en eau.
- Algorta Norte, inaugurée en 2012, avec une capacité de production de 4 000 t/an. Le traitement du minerai utilise de l’eau de mer acheminée par une canalisation de 75 km depuis Mejillones. La société est détenue à 74,5 % par le groupe familial De Urruticoechea et 25,5 % par le groupe japonais Toyota Tsusho.
- ACF Minera, détenue par le groupe familial De Urruticoechea, avec une capacité de production de 4 000 t/an.
- La société Atacama Minerals exploitant la mine d’Aguas Blancas, avec une capacité de production de 2 200 t/an a été acquise par le groupe chinois Tewoo. Le gisement s’étend sur 23 km de long, 4 km de large, sur une épaisseur de 0,5 à 5 m, surmonté d’une couche de stérile de 0,2 à 1 m. Le minerai a une teneur moyenne de 19,7 % en sulfates, 2,8 % en nitrates, environ 500 ppm en iode. Les réserves, fin 2013, sont de 80,9 millions de t de minerai renfermant 488 ppm d’iode.
Au Japon : la production d’iode provient de saumures extraites de gisements pétroliers et gaziers, situés à 80 % dans la préfecture de Chiba. 8 sociétés produisent de l’iode, avec 27 % des ventes mondiales, y compris le recyclage. Parmi celles-ci :
- Ise Chemical Corporation, est le principal producteur japonais avec 40 % du marché du pays et 15 % du marché mondial. Possède une filiale aux États-Unis, Woodward Iodine Corporation.
- Toyota Tsusho, produit de l’iode au Japon, aux États-Unis, à travers une filiale, Iochem et possède une participation dans une exploitation chilienne, Algorta Norte,
- Godo Shigen, produit et recycle de l’iode,
- Kanto Natural Gas Development (KNG),
- Nippoh Chemicals.
Aux États-Unis : la production d’iode provient de saumures extraites de gisements pétroliers et gaziers dans le bassin d’Anadarko, dans l’Oklahoma. 3 sociétés exploitent ces gisements, avec 5 % des ventes mondiales :
- Woodward Iodine Corporation, filiale du groupe japonais Ise Chemical Corporation, à Woodward, exploite 22 puits avec une capacité de production de 900 t/an.
- Iochem, filiale du groupe japonais Toyota Tsusho, à Vici, exploite 17 puits, avec une capacité de production de 1 200 t/an.
- Iofina, a produit, en 2019, à Alva, Burlington et Cherokee, 602,7 t de diiode.
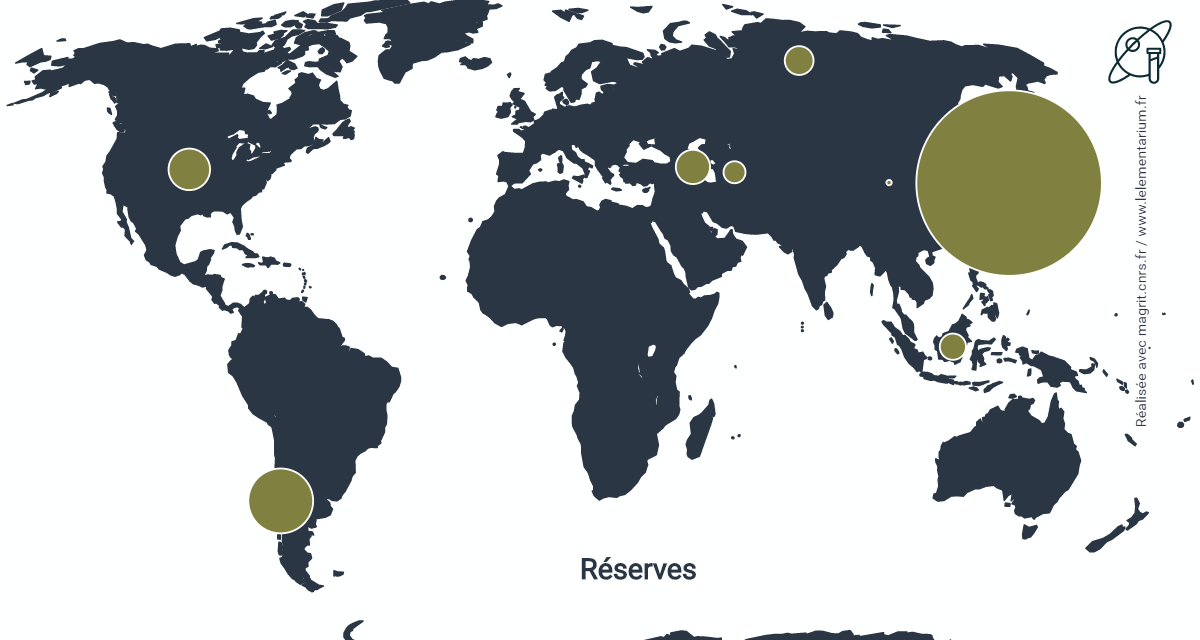
Réserves : elles sont estimées, en 2019, à 6,3 millions de t :
| Japon | 5 000 | Russie | 120 | |
| Chili | 610 | Indonésie | 100 | |
| États-Unis | 250 | Turkménistan | 70 | |
| Azerbaïdjan | 170 | Chine | 4 |
Source : USGS
Recyclage
En 2019, dans le monde, il représente 17 % de la consommation d’iode. Ce sont surtout les producteurs japonais qui sont actifs dans ce domaine avec 70 % du recyclage mondial. La principale source du recyclage est le diiode contenu dans les dispositifs à cristaux liquides.
Situation française
En 2019.
Production de composés chimiques de l’iode, par Ajay-SQM, à Evron (53).
Commerce extérieur :
Diiode :
- Exportations : 115 t vers la Belgique à 52 %, le Maroc à 21 %, la Hongrie à 7 %.
- Importations : 1 173 t du Chili à 64 %, du Japon à 24 %, du Royaume Uni à 11 %.
Iodures et iodates :
- Exportations : 618 t vers l’Allemagne à 30 %, la Belgique à 14 %, la Suisse à 10 %.
- Importations : 190 t d’Inde à 25 %, d’Allemagne à 20 %, du Chili à 19 %, de Belgique à 18 %, des États-Unis à 8 %.
Utilisations
Consommations : en 2019, dans le monde : 36 700 t dont 4 600 t, en 2018, aux États-Unis.
Secteurs d’utilisation : en 2019, dans le monde :
| Agent de contraste pour rayons X | 24 % | Dérivés fluorés (IF5, IF7) | 7 % | |
| Pharmacie | 13 % | Biocides | 6 % | |
| Affichages à cristaux liquides | 12 % | Nylon | 4 % | |
| Antiseptique et désinfectant | 8 % | Alimentation humaine | 3 % | |
| Alimentation animale | 7 % |
Source : SQM
Formes chimiques d’utilisation, aux États-Unis. Répartition, en 2015 :
| Iodométhane et iodoéthane | 51 % | Dihydroiodure d’éthylènediamine | 6 % | |
| Iodure de potassium | 15 % | Acide iodhydrique (HI) | 3 % | |
| Bétadine® | 8 % | Diiode bisublimée | 2 % | |
| Diode brut | 4 % | Iodure de sodium | 2 % |
Source : USGS
Le diiode brut à une pureté de 99,5 %, le diiode bisublimé, de 99,9 %.
L’une des difficultés d’utilisation du diiode est sa faible solubilité dans l’eau, 0,34 g/L, à 25°C, car de nombreuses utilisations, par exemple pour les examens médicaux ou comme antiseptique, nécessitent un emploi sous forme de solution. Lorsque c’est la présence de l’atome d’iode ou de l’un de ses isotopes radioactifs, qui est utile, comme en imagerie par rayons X ou en scintigraphie, il suffit d’employer un composé chimique hydrosoluble, non toxique, contenant l’atome d’iode. Lorsque c’est la présence du diiode qui est nécessaire, par exemple comme produit antiseptique, on peut former un complexe hydrosoluble, dans le cas de la bétadine® et du Lugol, ou utiliser un solvant du diiode, par exemple l’éthanol, lui même miscible en toutes proportions avec l’eau, dans le cas de la teinture d’iode.
- Agent de contraste pour rayons X : l’iode possède un numéro atomique élevé, 53, et l’absorption du rayonnement X est d’autant plus élevée que le numéro atomique est grand. L’iode est employé, généralement sous forme d’injection, pour augmenter le contraste des organes dans lesquels l’iode sera présente et réaliser ainsi des angioscanner, coronarographie… Ces agents sont des dérivés du 1,3,5-triiodobenzène.
- Antiseptique et désinfectant : dans ce domaine, la principale utilisation est sous forme de bétadine® (ou iodure de povidone) qui est un complexe du diiode avec la polyvinylpyrrolidone, en solution aqueuse, qui contient 10 % de diiode lié et 1 % de diiode libre.
Les autres formes d’utilisation sont la teinture d’iode, solution de diiode à 7 % dans l’éthanol, en présence de 5 % d’iodure de potassium et le Lugol, solution de diiode dans une solution aqueuse d’iodure de potassium, avec 1 % de diiode et 2 % de KI, dans ce cas, il y a formation du complexe I3–. L’utilisation de la teinture d’iode a été le plus souvent remplacée par celle de la bétadine®. - Affichages à cristaux liquides : le diiode est présent dans les films polarisants qui enserrent les cristaux liquides. Ces films, en alcool polyvinylique (PVA), sont étirés puis trempés dans une solution de diiode. Le diiode se fixe sur les chaînes de polymère alignées dans une direction lors de l’étirage et crée ainsi une chaîne conductrice conférant au film une conductivité fortement anisotropique, importante dans le sens des chaînes, quasi nulle perpendiculairement. Ainsi, le film est opaque pour les ondes dont le champ électrique est parallèle aux chaînes et transparent à celles polarisées perpendiculairement.
- L’iodure de potassium est, en particulier, en France, distribué à la population vivant autour des centrales nucléaires, dans un rayon de 10 km, sous forme de comprimés renfermant 65 mg de KI pour les enfants entre 3 et 12 ans et 130 mg de KI pour les adultes. Ces comprimés sont destinés à saturer la glande thyroïde en iode, afin de limiter la fixation de 131I, radioactif, émis lors d’accidents nucléaires.
- L’iodure de sodium, est employé dans le sel de table à des teneurs comprises entre 15 à 20 mg d’ion iodure/kg de sel.
- Catalyse : sous forme d’acide iodhydrique (HI), utilisé comme co-catalyseur, avec de l’iridium, dans la production d’acide acétique selon le procédé Cativa.
- Alimentation animale : l’iode est introduite sous forme de dihydroiodure d’éthylènediamine (EDDI) .
- Lampes halogènes : les lampes à incandescence classiques sont constituées par un filament de tungstène spiralé ou doublement spiralé chauffé par effet Joule jusqu’à 2400-2800°C. Leur durée de vie, environ 1 000 h, est limitée par la sublimation du tungstène. Lorsque celle-ci atteint 2 à 3 %, appelée perte mortelle, le filament se brise. De plus, le tungstène qui quitte le filament noircit le verre de la lampe et diminue au cours du temps son efficacité lumineuse. La présence de gaz rare permet, par rapport au vide, de réduire la sublimation du tungstène. La pression gazeuse, 80 kPa à 20°C, à l’intérieur de la lampe, est telle qu’en fonctionnement, elle équilibre la pression atmosphérique. L’argon, en présence d’environ 10 % de diazote qui permet d’éviter les arcs électriques, est généralement employé. Le krypton, plus cher, qui a une conductibilité thermique inférieure à celle de l’argon permet d’élever la température du filament et ainsi d’augmenter l’efficacité lumineuse de plus de 10 % tout en évitant un trop fort échauffement de l’ampoule en verre.
Dans les lampes halogènes, la présence de diiode, introduit sous forme d’iodure de méthyle, ou surtout de dibrome, introduit sous forme de bromure de méthyle ou de méthylène, ajouté en faible quantité dans le gaz rare contenu dans la lampe permet de former des halogénures de tungstène gazeux (WI2 avec l’iode) à partir du tungstène sublimé et de redéposer, par décomposition de ces halogénures, le tungstène sur le filament. Ce même principe est utilisé dans la purification des métaux (Ti…) selon le procédé Van Arckel. Le filament peut ainsi être porté à plus haute température, ce qui favorise la décomposition de l’halogénure de tungstène, tout en évitant le noircissement de l’ampoule. La pression gazeuse est, en fonctionnement, de 200 à 300 kPa (2 à 3 fois la pression atmosphérique). Celle-ci est obtenue en plongeant, lors de leur remplissage, les ampoules dans du diazote liquide.
La réaction chimique entre les halogènes et la vapeur de tungstène ayant lieu à une température qui peut atteindre 650°C, il est nécessaire d’éviter des points froids inférieurs à cette température et, en particulier, il faut que l’ampoule atteigne au moins cette température. Pour cela, celle-ci doit être proche du filament pour être chauffée par ce dernier, et doit être, pour résister à la température, en silice vitreuse (température de ramollissement : 1580°C) ou en verre « dur » aluminosilicaté (composition moyenne : SiO2 : 63 %, Al2O3 : 16 %, BaO : 12 %, CaO : 9 %, température de ramollissement : 1020°C).
La silice vitreuse présente l’inconvénient de cristalliser, puis de se briser au refroidissement, lorsqu’elle est en contact prolongé, à chaud, avec les ions Ca2+ et K+ contenus dans la graisse apportée par un contact éventuel avec des doigts. L’utilisation de la silice vitreuse (qui contrairement au verre est transparente au rayonnement UV) ne permet pas l’emploi, dans l’éclairage automobile, de vitres extérieures de phares en matériaux plastiques (qui sont détériorés par les rayons UV). Ils sont en verre, sauf traitement particulier de l’ampoule de la lampe réduisant l’émission UV. Également, du fait de cette transparence de la silice aux rayonnement UV, il n’est pas recommandé d’utiliser des lampes aux halogènes, non protégées (filtre, écran, double ampoule) en éclairage direct. - Iode radioactive : l’isotope 131I, de 8 jours de demi-vie, est employé pour détruire en tout ou partie la glande thyroïde. L’isotope 123I, de 13 h de demi-vie, est employé en scintigraphie de la thyroïde.
L’iode dans le corps humain
Elle sert exclusivement à synthétiser deux hormones : la thyroxine (T4) et la triiodothyronine (T3). La demi-vie de la T4 est de 6,5 jours, celle de la T3, de 2,5 jours. En conséquence, ces hormones sont synthétisées en permanence et le corps humain a un besoin d’apports réguliers en ions iodure. Il varie de 60 à 100 µg/j pour des enfants de 1 à 10 ans, 100 à 150 µg/j pour un adulte à 150 à 250 µg/j pour des grossesses ou des femmes allaitantes.
En France, les apports quotidiens sont compris entre 80 et 120 µg.
Contenu en iode de divers aliments :
| Algues | 4 500 | Crustacés | 30 | |
| Sel iodé | 1 500 | Laitages | 20 | |
| Cabillaud | 500 | Viande | 5 | |
| Œufs | 50 | Eau | 2 à 15 |
Au Royaume Uni, de l’iode est ajouté au lait de consommation.
Bibliographie
- Rapport d’activité de la société SQM, El Trovador 4285, 10th Fl, Las Condes, Santiago, Chili.
- World Iodine Association, Keizerstraat 29, 1740 Ternat, Belgique.
- K. Hora, « Iodine production and industrial applications« , World Iodine Association, août 2016.
- Cochilco, Ministère des Mines du Chili.
- P. Blazy et E-A. Jdid, « Iode », Techniques de l’Ingénieur, 2009.
- I. Garcés Millas, « La industria del yodo en Chile : procesos, produccion, mercado y usos« , Universidad de Antofagosta, 2000.