Le diazote atmosphérique n’est pas, en général, assimilé directement par les plantes (sauf par les légumineuses). Par contre, l’azote sous forme d’ions nitrate (NO3–) est directement assimilable mais est facilement entraîné, par les eaux de pluie, par lessivage. Par contre l’azote sous forme d’ions ammonium qui se lient électrostatiquement aux argiles du sol est fixé dans le sol. Les engrais azotés, élaborés principalement à partir d’ammoniac, renferment de l’azote sous forme d’ions nitrate ou/et d’ions ammonium.
Données industrielles
L’élément azote est l’un des constituants des acides aminés et des protéines ainsi que de la chlorophylle qui contrôle la photosynthèse.
Les plantes doivent s’alimenter en azote à partir du sol car le diazote atmosphérique n’est pas, en général, assimilé directement par les plantes (sauf par les légumineuses). L’azote présent dans les sols sous forme d’ions nitrate (NO3–) est directement assimilable (effet rapide) mais il est facilement entraîné, par les eaux de pluie, par lessivage. Par contre l’azote sous forme d’ions ammonium (NH4+) qui se lient électrostatiquement aux argiles du sol, chargées négativement, est fixé dans le sol. Pour être assimilable par les plantes (sauf pour le riz dont la plante peut assimiler directement l’ion ammonium) l’ion ammonium doit être préalablement oxydé en ion NO3– par des bactéries (nitrosomas, nitrobacter) contenues dans le sol, en présence du dioxygène de l’air (effet retard).
Dans les plantes, l’ion nitrate est transféré aux feuilles où, en présence de nitrate réductase, il est réduit en ion ammonium et métabolisé en ion amide NH2–, qui conduit à la formation des acides aminés.
L’humus a une teneur de 5 % en azote organique en grande partie non assimilable. Chaque année, 1 à 2 % de cet azote (soit 40 à 80 kg de N/ha/an) passe à l’état NO3–, c’est la minéralisation. Une partie du NO3– présent dans l’humus (soit environ 30 kg de N/ha/an) est transformé par des microbes anaérobies en NO2– et N2 (c’est la dénitrification).
Les besoins en N, par hectare, pour une production de blé de 70 quintaux sont, en moyenne, de 250 kg. Seuls, 210 kg sont consommés, car il y a, en particulier, 20 kg de dénitrification. Sur cette consommation, 155 kg proviennent des engrais, 65 kg d’azote organique, 30 kg d’apports naturels (pluies…).
Fixation du diazote de l’air par les plantes : d’après La Recherche, n°199, mai 1988.
Quelques plantes (fougère Azolla en Asie, légumineuse Sesbania Rostrata en Afrique) en association avec des micro-organismes (bactéries du genre Rhizobium) pour S. Rostrata peuvent fixer le diazote de l’air et être utilisées comme « engrais vert » pour la culture du riz. A l’échelle mondiale on estime que 75 millions de t de N2 sont ainsi accumulées soit l’équivalent de 160 millions de t d’engrais chimiques. S. Rostrata peut fixer 200 à 300 kg de N2 par ha en 50 jours et permet de faire passer le rendement en riz de 2 à 4 t/ha ce qui équivaut à un apport d’engrais chimiques de 60 à 80 kg.
Le trèfle fixe 150 kg de N/hectare/an, la luzerne 180 kg de N/ha/an.
Matières premières
Le gaz naturel fournit, en 2015, dans le monde, 69 % de l’ammoniac nécessaire à la fabrication des engrais azotés. Le charbon et le gaz de cokerie comptent pour 29 % (à 95 % en Chine), le fuel ou le naphta pour 2 %.
Fabrication industrielle
Elle nécessite la production d’ammoniac (voir les chapitres consacrés au dihydrogène et à l’ammoniac) lui même obtenu par production de dihydrogène obtenu principalement par reformage à la vapeur d’eau du méthane du gaz naturel puis conversion du monoxyde de carbone selon les équations suivantes :
CH4 + H2O = CO + 3 H2
CO + H2O = CO2 + H2
Le dioxyde de carbone est récupéré si de l’urée est fabriquée.
L’ammoniac est ensuite obtenu par synthèse catalytique avec un catalyseur à base de fer, le diazote (de l’air) étant introduit lors de la fabrication du dihydrogène. Environ 82 % de l’ammoniac produit dans le monde est utilisé pour la fabrication d’engrais.
Composés chimiques fabriqués
Les produits suivants sont utilisés comme engrais azotés :
Ammoniac : NH3. Il est employé sous forme de gaz liquéfié sous pression injecté dans le sol. Cette utilisation directe de l’ammoniac est surtout pratiquée aux États-Unis où elle représente, en 2017, 24,3 % de la fertilisation azotée. Elle n’est pas employée en France.
Urée : CO(NH2)2. Elle est obtenue par action du dioxyde de carbone issu du reformage, sur l’ammoniac, sous pression (140 à 250 bar), à 190°C (environ 35 % l’ammoniac produit dans le monde est utilisé pour fabriquer de l’urée). Il se forme du carbamate d’ammonium, NH2-CO2-NH4, qui est déshydraté en urée. Les unités de production ont des capacités de 1 000 à 2 000 t/jour. C’est l’engrais azoté le plus riche en N avec une teneur de 46 %. Son action a lieu par hydrolyse lente et formation d’ammoniac selon l’équation suivante :
CO(NH2)2 + 2 H2O = 2 NH3 + CO2 + H2O
En France, l’urée est utilisée (surtout dans le Sud-Ouest et en Alsace, régions productrices de maïs) seule ou en solutions 50/50 avec NH4NO3. C’est le principal engrais azoté utilisé dans le monde. Elle convient aux pays tropicaux (les ammonitrates sont trop solubles) en particulier pour la culture du riz mais aussi aux régions froides ou tempérées, sauf dans les sols sablonneux ou très calcaires. 90 % de l’urée est destinée à la production d’engrais. Les 10 % restants sont utilisés pour fabriquer des colles urée-formol, de la mélamine, des dérivés isocyanuriques, dans l’alimentation animale, l’extraction des paraffines…
La production mondiale est, en 2018, comptée en N, de 79,1 millions de t. Elle fait l’objet d’un important commerce international, avec 22,2 millions de t de N, en 2018.
Nitrate d’ammonium (dénommé ammonitrate) : NH4NO3. Il est préparé, à 160°C, sous 3 bar, par neutralisation de l’acide nitrique par l’ammoniac. L’acide nitrique est lui-même préparé par oxydation catalytique de l’ammoniac sur grilles de platine (voir le chapitre consacré à HNO3). Les unités de production ont des capacités de 1 500 à 3 000 t/jour.
Le titre en N (35 % maximum) varie à l’aide d’une charge, en général calcaire. Du nitrate de magnésium (1,6 %) est ajouté pour stabiliser NH4NO3 sous sa forme orthorhombique IV (changement de forme à 32°C) et éviter la désagrégation des granulés, puis la prise en masse qui augmente les risques de détonation.
Le nitrate d’ammonium est utilisé dans la fabrication d’engrais sous forme d’engrais NP, NPK, de solutions urée-nitrate et surtout solide comme engrais simple, dénommé ammonitrate. C’est l’engrais azoté le plus utilisé en France, où il représente, en 2017-18, 36 % de la fertilisation azotée.
En 2018, la production mondiale, comptée en N, est de 16,3 millions de t. Une partie de la production est employée en utilisation directe comme engrais, une autre partie pour préparer des solutions d’engrais et enfin une dernière partie dans des applications industrielles, en dehors de l’industrie de engrais, comme, par exemple, l’industrie de explosifs. Le commerce international a porté sur 3,1 millions de t, comptées en N.
Sulfate d’ammonium : (NH4)2SO4. C’est un sous-produit des fabrications de caprolactame, acrylonitrile, coke sidérurgique mais il est également synthétisé à partir d’ammoniac et d’acide sulfurique. En 2018, la production mondiale est de 5,6 millions de t comptées en N et le commerce international de 2,8 millions de t, comptées en N.
Phosphates d’ammonium (engrais binaire NP) : diammonique (DAP) : (NH4)2HPO4 et monoammonique (MAP) : NH4H2PO4. Ils sont obtenus par neutralisation de NH3 par H3PO4 (voir les engrais phosphatés). La production mondiale de phosphate diammonique est, en 2018, de 6,1 millions de t comptées en N, celle de phosphate monoammonique de 3,1 millions de t comptées en N.
Divers : nitrate de sodium naturel du Chili, cyanamide calcique (CaCN2), nitrate de potassium (engrais binaire NK, par attaque à l’acide nitrique de KCl), chlorure d’ammonium (utilisé surtout en riziculture au Japon et en Inde), hydrogénocarbonate d’ammonium (utilisé en Chine), nitrate de calcium et d’ammonium.
Une partie de la production d’engrais azotés est commercialisée sous forme de solutions urée – nitrate d’ammonium.
Évolution de la production d’engrais azotés au cours des XIX et XXème siècle.
| Années | Nitrate du Chili |
Guano | Sulfate d’ammonium sous produit de la distillation du charbon |
Cyanamide calcique |
Ammoniac synthétique |
Total |
| 1850 | 5 | – | 0 | 0 | 0 | 5 |
| 1860 | 10 | 70 | 0 | 0 | 0 | 80 |
| 1880 | 50 | 30 | 0 | 0 | 0 | 80 |
| 1900 | 220 | 20 | 120 | 0 | 0 | 360 |
| 1920 | 410 | 10 | 290 | 70 | 150 | 950 |
| 1940 | 200 | 10 | 450 | 290 | 2 150 | 3 100 |
| 1960 | 200 | – | 950 | 300 | 9 540 | 10 990 |
| 1980 | 90 | – | 970 | 250 | 59 290 | 60 600 |
| 2000 | 120 | – | 370 | 80 | 85 130 | 85 700 |
Le nitrate de sodium du Chili est exploité depuis 1804 dans le désert d’Atacama situé initialement dans 3 pays : Chili, Pérou et Bolivie. Il contient de 1 à 5 % de N. Il est extrait par lixiviation à l’eau chaude. Après la guerre du salpêtre (1879-1884), le Chili a annexé le gisement.
Le guano, formé par les déjections d’oiseaux, s’est accumulé (jusqu’à 60 m d’épaisseur) par exemple sur un ensemble d’îles au large des côtes péruviennes. Sa teneur est de 14 % de N et 14 % de P2O5.
Le sulfate d’ammonium était initialement produit lors de la fabrication du gaz manufacturé (ou gaz à l’eau) utilisé comme gaz de ville ou d’éclairage. Ce gaz contient de 0,7 à 1,5 % d’ammoniac qui est précipitée en sulfate d’ammonium. Actuellement, il est récupéré lors de l’élaboration du coke.
La cyanamide calcique est fabriquée par réaction du carbure de calcium avec le diazote de l’air, vers 1100°C, selon l’équation suivante :
CaC2 + N2 = Ca(CN)2 + C
Productions
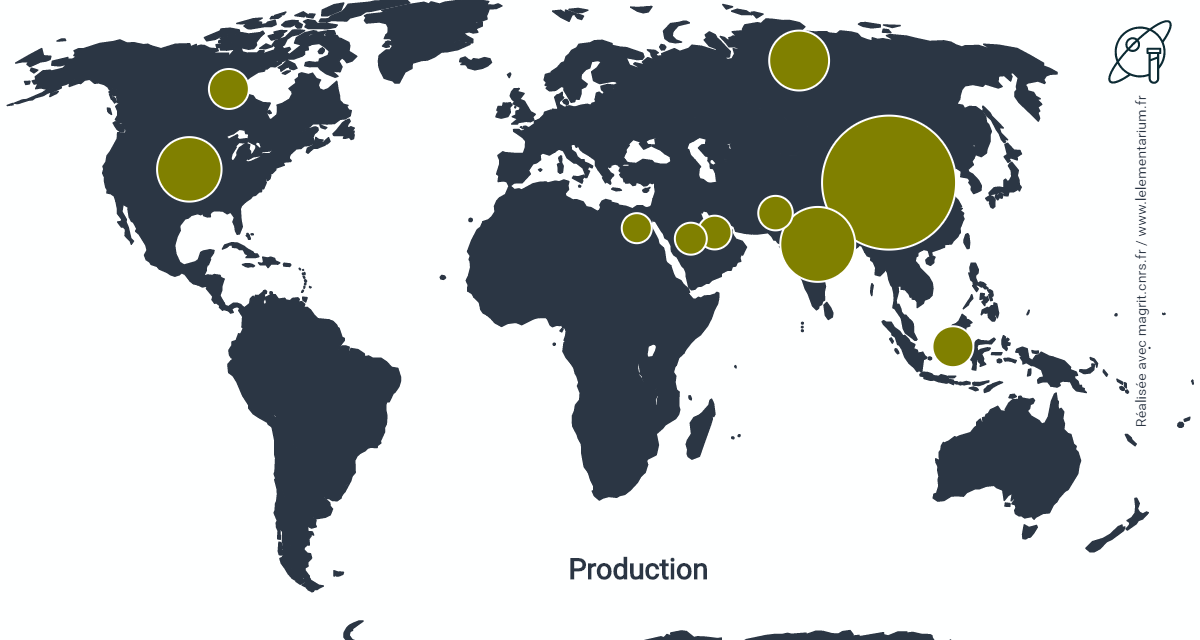
Dans le monde, en 2018 : 119,615 millions de t de N, dans l’Union européenne : 11,390 millions de t de N.
| Chine | 32 743 | Canada | 3 822 | |
| Inde | 13 337 | Égypte | 3 700 | |
| États-Unis | 11 265 | Pakistan | 3 063 | |
| Russie | 10 421 | Qatar | 2 937 | |
| Indonésie | 4 022 | Arabie Saoudite | 2 526 |
Principaux pays exportateurs : en 2018, sur un total de 43,361 millions de t de N dont 9,360 millions de t de N pour l’Union européenne.
| Russie | 7 081 | États-Unis | 1 826 | |
| Chine | 4 948 | Belgique | 1 588 | |
| Qatar | 2 289 | Iran | 975 | |
| Arabie Saoudite | 2 139 | Lituanie | 903 | |
| Pays Bas | 1 964 | Malaisie | 867 |
Source : FAO
Principaux pays importateurs : en 2018, sur un total de 42,322 millions de t de N dont 11,864 millions de t de N pour l’Union européenne.
| Brésil | 4 598 | Turquie | 1 376 | |
| Inde | 3 894 | Mexique | 1 297 | |
| États-Unis | 2 874 | Australie | 1 277 | |
| France | 1 990 | Espagne | 1 106 | |
| Thaïlande | 1 483 | Allemagne | 963 |
Source : FAO
Situation française
En t de N.
Production, en 2018 : 579 589 t de N.
Commerce extérieur : en 2018, en t de N.
Ammonitrates sous toutes formes y compris en présence de carbonate de calcium, hors solutions avec l’urée :
- Exportations : 235 569 t vers l’Allemagne à 15 %, les Pays Bas à 12 %, la Belgique à 11 %, le Royaume Uni à 8 %.
- Importations : 358 783 t de Belgique à 50 %, des Pays Bas à 14 %, d’Espagne à 12 %, de Lituanie à 11 %.
Sulfate d’ammonium :
- Exportations : 9 719 t vers l’Allemagne à 56 %, la Suisse à 5 %.
- Importations : 147 258 t des Pays Bas à 43 %, de Belgique à 31 %, d’Espagne à 17 %.
Urée sous toutes formes, hors solutions avec le nitrate d’ammonium :
- Exportations : 119 997 t vers l’Espagne à 71 %, le Royaume Uni à 9 %.
- Importations : 783 049 t d’Égypte à 27 %, d’Algérie à 23 %, de Russie à 12 %, des Pays Bas à 9 %.
Solutions urée – nitrate d’ammonium :
- Exportations : 413 t vers la Belgique à 53 %, le Royaume Uni à 34 %, l’Allemagne à 12 %.
- Importations : 715 595 t des États-Unis à 35 %, de Russie à 23 %, des Pays Bas à 14 %, de Trinidad et Tobago à 11 %, de Lituanie à 8 %.
Consommation, en 2017-18 : 2,248 millions de t de N dont :
- Ammonitrate : 806 milliers de t de N (2 660 milliers de t de produit)
- Solutions : 699 milliers de t de N (2 341 milliers de t de produits)
- Urée : 483 milliers de t de N (1 050 milliers de t de produits)
- Autres simples : 67 milliers de t de N (299 milliers de t de produits)
- NK et NPK : 103 milliers de t de N (698 milliers de t de produits)
- DAP-MAP : 49 milliers de t de N (278 de t de produits)
- Autres NP : 35 milliers de t de N (185 milliers de t de produits)
- Autres : 6 milliers de t de N (108 milliers de t de produits).
Consommation à l’hectare : 85,9 kg de N.
Utilisations
| Engrais | Monde | Chine, en 2018 |
Inde, en 2018 | États-Unis, en 2018 | France, en 2018 |
|
| 1973-74 | 2018 | |||||
| Urée | 8 330 | 49 857 | 7 180 | 14 452 | 2 798 | 431 |
| Ammonitrate | 7 300 | 6 135 | 0 | 0 | 206 | 480 |
| Phosphates d’ammonium | 1 023 | 7 513 | 1 800 | 1 658 | 644 | 55 |
| Ammoniac | 3 580 | 3 576 | 0 | 0 | 2 762 | 0 |
| Solutions | 2 120 | 5 871 | 6 | 0 | 3 055 | 706 |
| Sulfate d’ammonium | 2 760 | 4 091 | 51 | 115 | 342 | 22 |
| Ternaires NPK | 6 100 | 18 320 | 13 095 | 441 | 615 | 83 |
| Total | 39 220 | 103 705 | 23 316 | 17 638 | 11 297 | 2 137 |
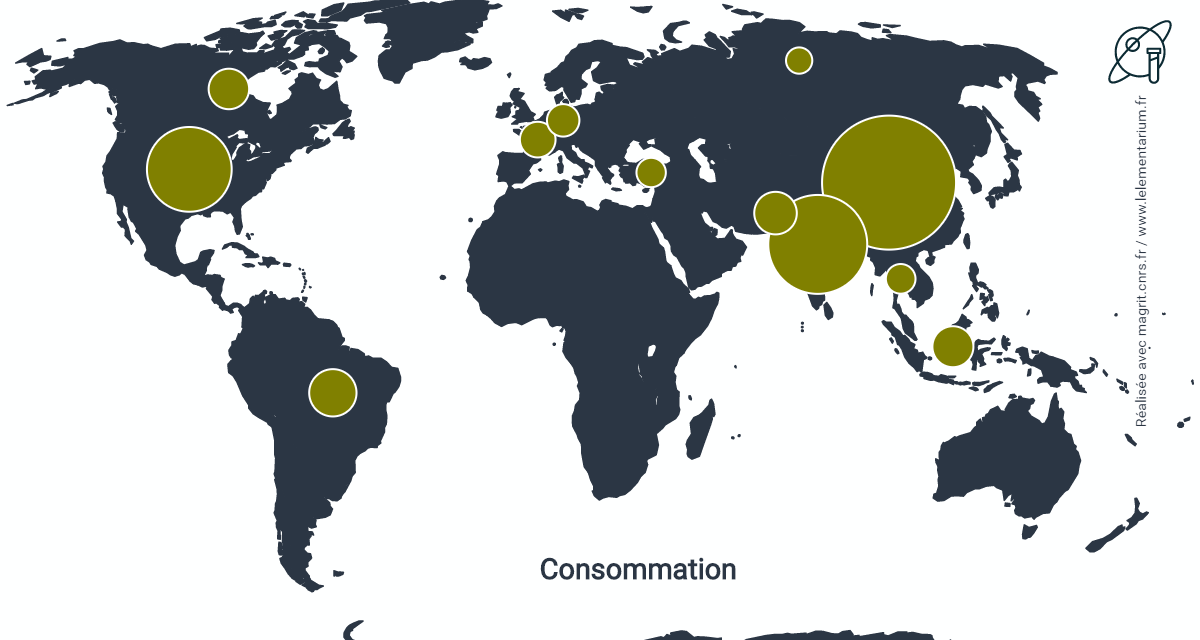
Consommation par pays : en 2018. Monde : 108,658 millions de t de N, Union européenne : 11,031 millions de t de N.
| Chine | 28 306 | Canada | 2 769 | |
| Inde | 17 628 | France | 2 248 | |
| États-Unis | 11 644 | Vietnam | 1 573 | |
| Brésil | 5 120 | Russie | 1 542 | |
| Pakistan | 3 447 | Turquie | 1 528 | |
| Indonésie | 3 237 | Thaïlande | 1 516 |
Problèmes
Sécurité : le nitrate d’ammonium est un composé qui dans certaines conditions peut exploser. En effet, le mélange de NH4NO3 avec 6 % de fuel est l’explosif industriel le plus utilisé, l’amorçage étant réalisé avec de la dynamite. Par ailleurs, au-dessus de 195°C, NH4NO3 risque de se décomposer avec explosion.
- Le 21 septembre 1921, dans l’usine BASF d’Oppau, en Allemagne, l’explosion de 5 400 t de sel double NH4NO3-(NH4)2SO4 a fait de 500 à 600 morts.
- Le 16 avril 1947, l’explosion de 2 bateaux à Texas City a fait 561 morts puis, plus tard, d’un bateau à Brest, 22 morts : les granulés de NH4NO3 étaient enrobés de 1 % de cire combustible.
- Du nitrate d’ammonium a été utilisé lors de l’attentat d’Oklahoma City, aux États-Unis, le 19 avril 1995 qui a fait 167 morts.
- Le 21 septembre 2001, à 10h17, 300 à 400 t de nitrate d’ammonium ont explosé à l’usine AZF de Toulouse entraînant la destruction de l’usine, la mort de 30 personnes (22 dans l’usine et 8 à l’extérieur) et plus de 2 000 blessés.
- Le 4 août 2020, explosion dans le port de Beyrouth de 2 750 t de nitrate d’ammonium avec plus de 200 morts.
Économiques : le prix de revient des engrais azotés est lié au coût du gaz naturel (50 % du prix de revient des ammonitrates). Les pays producteurs de gaz naturel (Pays du Golfe, Russie) ont développé une industrie de l’ammoniac extrêmement concurrentielle.
Écologiques : les ions nitrates peuvent entraîner une pollution des eaux, voir le chapitre consacré à l’eau.
Bibliographie
- G. Guiochon, BUP n°841, vol.96, février 2002, p 341.
- Le Monde, 23-24 septembre 2001.
- Cuide 6, n°30, 1986, Université M. et P. Curie.
- Documents de l’Union des Industries de la Fertilisation, 14 rue de la République, Cedex 99, 92909 Paris La Défense.
- International Fertiliser Association (IFA), 49 av. d’Iéna, 75116 Paris.
- FAO, Viale delle Terme di Caracalla, 00153 Rome, Italie.
- Informations de Fertilizers Europe, Av E. Van Nieuwenhuyse, 4, B-1160, Bruxelles, Belgique.
- « Le stockage du nitrate d’ammonium et des ammonitrates solides, prévention des risques professionnels« , INRS, Recommandation R 428, février 2010.
- R. Sicre, les Engrais, CRDP Nantes.