Le nom du sélénium vient de Séléné, la déesse grecque de la Lune. Lors de sa découverte, en 1817 par Jons Jakob Berzelius et son assistant Johann Gottlieb Gahn, il a été remarqué que l’élément est très souvent associé au tellure qui, lui, est nommé d’après la Terre. Ce fut donc Berzelius qui décida de nommer ce nouvel élément en raison de leur présence conjuguée dans la nature, comme le sont la Terre et la Lune dans l’Univers.
Données physico-chimiques
Données atomiques
| Numéro atomique | Masse atomique | Configuration électronique | Structures cristallines | Rayon métallique pour la coordinence 12 |
| 34 | 78,97 g.mol-1 | [Ar] 3d10 4s2 4p4 | formes alpha et bêta, monocliniques donnant le sélénium gris, stable, vers 200°C. La forme grise est hexagonale de paramètres a = 0,4366 nm et c = 0,4959 nm | 140 pm |
Données physiques
| Masse volumique | Dureté | Température de fusion | Température de sublimation | Conductibilité électrique | Conductibilité thermique | Solubilité dans l’eau |
| 4,81 g.cm-3 | 2 | 217°C | 684,9°C | 1,0.10-4 S.m-1 | 2,04 W.m-1.K-1 | insoluble |
Données chimiques
| Électronégativité de Pauling | pKa : H2Se/HSe– | pKa : HSe– /Se2- | pKa : H2SeO3/HSeO3– | pKa : HSeO3– /SeO32- | pKa : HSeO4– /SeO42- |
| 2,48 | 3,9 | 11 | 2,6 | 8,3 | 1,9 |
Potentiels standards :
| Se(s) + 2e = Se2- | E° = -0,92 V |
| Se(s) + 2H+ + 2e = SeH2 | E° = -0,40 V |
| SeO42- + H2O + 2e = SeO32- + 2OH– | E° = 0,05 V |
| HSeO4– + 3H+ + 2e = H2SeO3 + H2O | E° = 1,09 V |
| SeO32- + 3H2O + 4e = Se(s) + 6OH– | E° = -0,37 V |
| SeO42- + 4H+ + 2e = H2SeO3 + H2O | E° = 1,15 V |
| H2SeO3 + 4H+ + 4e = Se(s) + 3H2O | E° = 0,74 V |
Données thermodynamiques
Sélénium gris :
|
Sélénium gazeux :
|
Données industrielles
Matières premières
La teneur de l’écorce terrestre est de 0,05 ppm.
Il n’existe pas de gisement propre de sélénium, celui-ci est, associé avec le tellure, principalement co-produit de la métallurgie du cuivre mais aussi de celles du plomb et du nickel. Le sélénium est présent dans des sulfures métalliques en substitution du soufre, sous forme de séléniures, dans lesquels le sélénium possède le degré d’oxydation -2, comme le soufre dans les sulfures, ou dans les parties oxydées, sous forme de sélénites, dans lesquels le sélénium possède le degré d’oxydation +4, comme le soufre dans les sulfites.
La métallurgie des minerais sulfurés de cuivre peut ainsi récupérer, en moyenne, 0,215 kg de Se/t de Cu et, pour des exploitations canadiennes, 0,64 kg de Se/t de Cu.
Fabrication industrielle
Comme co-production de la métallurgie du cuivre (voir le chapitre cuivre).
Le sélénium peut être récupéré lors du traitement, par pyrométallurgie, des minerais sulfurés de cuivre. Cela n’est pas le cas pour la voie hydrométallurgique.
Après le traitement pyrométallurgique des concentrés de cuivre, le sélénium, avec le tellure, se retrouve dans le blister, constitué, à 99 %, de cuivre. Celui-ci est purifié par électrolyse à anode soluble après avoir été coulé sous forme d’anodes et le cuivre, avec une pureté de 99,99 %, se dépose à la cathode. Lors de cette électrolyse, il se forme des boues qui renferment les impuretés, bismuth, or, argent, sélénium, tellure ainsi que de 15 à 35 % de cuivre. Celles-ci peuvent contenir de 5 à 25 % de sélénium, sous forme de séléniures et de tellurures, de cuivre, d’argent et d’or.
La plupart des raffineries de cuivre récupère ces boues mais elles ne sont exploitées pour la récupération du sélénium et des métaux précieux contenus que par une partie d’entre elles. Les autres les exportent vers les installations pratiquant cette récupération.
Le traitement des boues anodiques peut être réalisé selon 2 voies, après un traitement de lixiviation du cuivre, en général dans un autoclave, avec de l’acide sulfurique :
Par grillage alcalin qui consiste à chauffer les boues, vers 530-650°C, en présence de carbonate de sodium, afin d’oxyder le sélénium et le tellure sous forme de sélénate et tellurate, dans lesquels le sélénium et le tellure possèdent le degré d’oxydation +6, comme le soufre dans les sulfates, puis à effectuer une lixiviation à l’aide d’une solution d’hydroxyde de sodium. Le sélénate de sodium passe en solution, le tellurate reste dans la phase solide. Par exemple pour un séléniure de cuivre :
Cu2Se + Na2CO3 + 5/2 O2 = 2 CuO + Na2SeO4 + CO2
Le sélénate est réduit en sélénite à l’aide d’acide chlorhydrique concentré selon la réaction :
SeO42- + 2 HCl = SeO32- + H2O + Cl2
Puis le sélénite est réduit en sélénium, qui précipite, par du dioxyde de soufre ou des sels ferreux.
SeO32- + 2 SO2 + H2O = Se + 2 H+ + 2 SO42-
Par grillage sulfatant, en présence d’acide sulfurique, vers 500-600°C, le sélénium est volatilisé sous forme de dioxyde alors que le dioxyde de tellure reste dans la phase solide. Par exemple pour le séléniure de cuivre :
Cu2Se + 6 H2SO4 = SeO2(g) + 2 CuSO4(s) + 6 H2O(g) + 4 SO2(g)
Le dioxyde de soufre, formé lors du grillage, est utilisé, en partie, pour réduire le dioxyde de sélénium en sélénium selon la réaction :
SeO2(g) + 2 SO2(g) + 2 H2O(liq) = Se(s) + 2 H2SO4(liq)
Le sélénium obtenu contient des traces de tellure. Il est purifié par distillation sous vide, la température d’ébullition, à la pression atmosphérique, du sélénium étant de 685°C, celle du tellure, de 990°C.
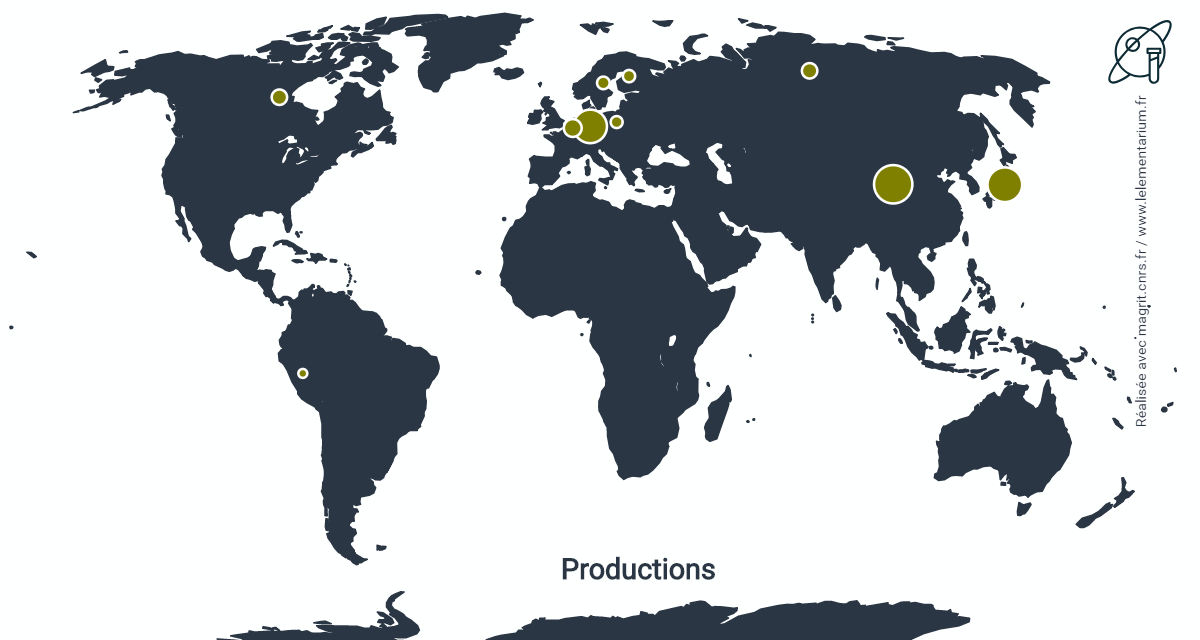
Productions
En 2019. Monde : 2 800 t.
| Chine | 930 | Finlande | 100 | |
| Japon | 770 | Pologne | 70 | |
| Allemagne | 300 | Canada | 60 | |
| Belgique | 200 | Turquie | 50 | |
| Russie | 150 | Suède | 50 |
Source : USGS
Aux États-Unis, Asarco, filiale de Grupo Mexico, à Amarillo, au Texas produit un concentré semi-raffiné renfermant 90 % de sélénium qui est exporté au Mexique pour la poursuite de son raffinage. Rio Tinto et Freeport-McMoRan exportent également les boues produites par leurs raffineries de Garfield dans l’Utah et de El Paso au Texas. Le sélénium provient de mines de cuivre de l’Arizona et de l’Utah.
En 2012, les importations chinoises ont porté sur 1 610 t de sélénium.
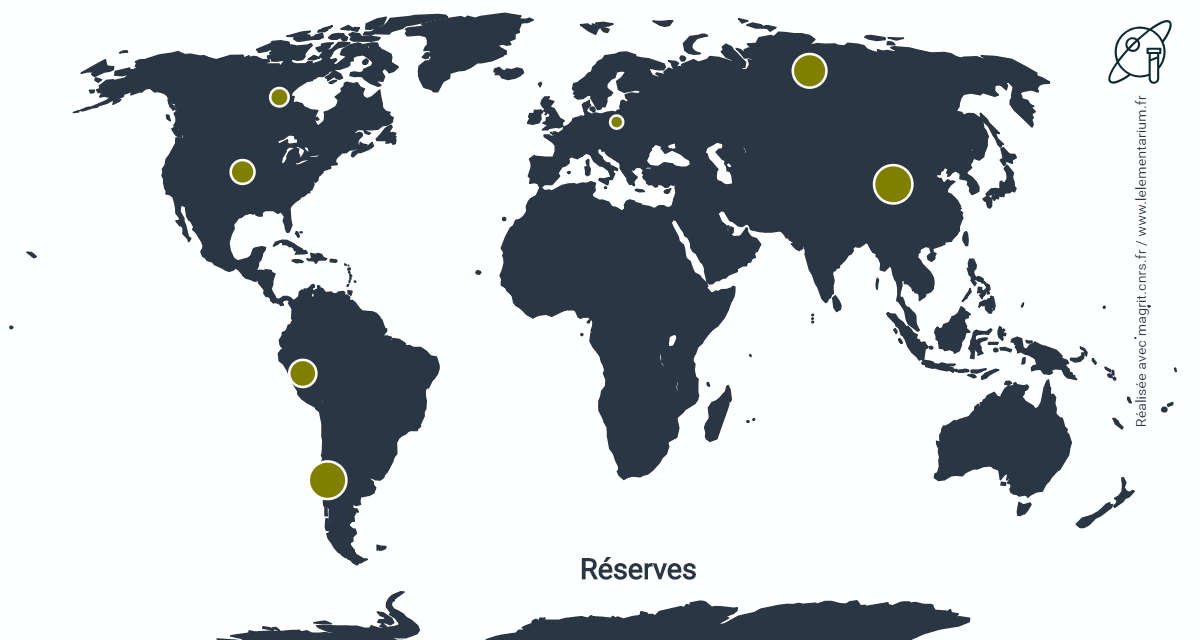
Réserves : estimées, en 2019, à partir des dépôts sulfurés de cuivre, elles sont de 99 000 t.
| Chine | 26 | États-Unis | 10 | |
| Chili | 25 | Canada | 6 | |
| Russie | 20 | Pologne | 3 | |
| Pérou | 13 |
Producteurs : on retrouve les principaux producteurs de cuivre.
- Glencore produit du sélénium en particulier dans sa raffinerie CCR à Montréal au Canada avec 225 t/an ainsi qu’au Kazakhstan à Ust Kamenogorsk avec sa filiale Kazzinc, détenue à 69,7 %, et 24 t/an et en Norvège dans sa raffinerie de nickel et cuivre de Kristiansand.
- Rio Tinto, produit 170 t/an.
- Grupo Mexico produit du sélénium à travers ses filiales, Asarco, aux États-Unis, à Amarillo, au Texas et Southern Copper, à Ilo, au Pérou et La Caridad au Mexique.
- Aurubis (Allemagne), possède une capacité de production de 250 t/an, à partir de concentrés de cuivre importés, dans ses raffineries de Hambourg, en Allemagne, Olen, en Belgique et Pirdop, en Bulgarie. L’obtention de sélénium à 99,999 % de pureté est effectuée par sa filiale Retorte, à Röthenbach et Kirchheim en Allemagne ainsi qu’à Joinville au Brésil.
- Umicore, dans sa raffinerie de Hoboken, en Belgique, possède une capacité de production de 600 t/an, avec une production de 100 à 200 t/an.
- Uralelectromed, filiale de Ural Mining and Metallurgical (UMMC) possède, en Russie, à Verkhnyaya, dans la région de Sverdlovsk, une capacité de production de 40 t/an.
- KGHM, en Pologne, exploite 3 mines souterraines de cuivre, à Lubin, Polkowice-Sieroszowice et Rudna, avec la production de concentrés de cuivre renfermant de 18 à 22 % de cuivre, 12 % de soufre, 1 900 g d’arsenic/t , 700 g d’argent/t, 45 g de sélénium/t. Les concentrés sont traités dans les fonderies et raffineries de Legnica et Glogów et les boues d’anodisation sont traitées à Glogów, avec, en 2016, une production de 81,7 t de sélénium de qualité technique à 99,94 %.
- Boliden, possède une capacité de production de 100 t/an de sélénium à 99,5 % dans ses raffineries de Rönnskär, en Suède et Harjavalta, en Finlande.
Recyclage
Il concerne, pour l’instant, le sélénium présent sur les tambours des anciennes photocopieuses qui sont récupérées en fin de vie. Cela représente de 100 à 200 t/an. Dans cette application, le sélénium, déposé en couche mince de 50 à 60 µm, était employé pour ses propriétés photoconductrices. Il est isolant en absence de lumière et conducteur lorsqu’il est éclairé. Depuis les années 1990, le sélénium est remplacé par des photoconducteurs organiques.
Situation française
En 2019.
Les exportations de sélénium étaient de 5,164 t avec comme principaux marchés à :
- 36 % l’Allemagne,
- 12 % l’Algérie,
- 12 % la Belgique,
- 10 % le Mexique,
- 9 % l’Italie.
Les importations de sélénium s’élevaient à 34,052 t en provenance principalement à :
- 30 % d’Italie,
- 24 % de Belgique,
- 17 % d’Allemagne,
- 6 % du Royaume Uni.
Utilisations
Consommations annuelles : environ 3 500 t, en 2017, la Chine représentant de 40 à 50 % de la consommation mondiale.
Secteurs d’utilisation : en 2019, dans le monde.
| Métallurgie | 40 % | Chimie et pigments | 10 % | |
| Verre | 25 % | Électronique | 10 % | |
| Agriculture | 10 % |
- Métallurgie : en Chine, 75 % de la consommation est destiné à la production de manganèse par voie électrolytique où il remplace le dioxyde de soufre. Dans cette application, la consommation est de 1,2 à 2 kg de SeO2/t de manganèse.
Par ailleurs, il entre comme ajout dans le cuivre et les aciers pour faciliter leur usinage. - Soudage : employé, avec le bismuth, comme alliage de brasage, en remplacement des soudures au plomb.
- Industries verrières : le sélénium est employé comme décolorant dans le verre d’emballage en faisant disparaitre la couleur verte apportée par les traces d’oxyde de fer présentes dans la silice. Dans un premier temps, de l’oxyde d’arsenic oxyde Fe(II) en Fe(III) puis le sélénium ou des sélénites de baryum ou de sodium sont ajoutés à des teneurs de 10 à 30 g de Se/t de verre. Seul 20 % du sélénium reste présent dans le verre car la plus grande partie est volatilisée.
Dans les vitrages pour la construction et l’automobile, il réduit la transmission de la chaleur solaire. - Pigment : il est employé dans des matières plastiques, des céramiques et des verres, sous forme de sulfoséléniure de cadmium, pour donner une couleur variant du jaune au rouge. En particulier il colore en rouge vif les feux de signalisation. Cette application est en décroissance du fait de la toxicité du cadmium.
- Chimie : il est employé comme catalyseur.
- Électronique : il est employé dans des redresseurs de courant, des cellules photoélectriques, en détection infrarouge pour des longueurs d’onde comprises entre 1,5 et 5,2 µm.
- Photovoltaïque : employé pour élaborer des couches minces d’environ 2 µm d’épaisseur de disélénium de cuivre et d’indium (CIS) ou de diséléniure de cuivre, indium, gallium (CIGS) pour panneaux solaires.
- Hygiène : employé dans les shampoings antipelliculaires, sous forme de sulfure de sélénium, SeS ou SeS2, à des teneurs de 0,5 à 1 %.
- Complément alimentaire : les apports recommandés dans l’alimentation humaine sont de 20 à 70 µg/jour. Il est, en général apporté par l’alimentation. Par exemple le thon, les moules, le foie renferment de 40 à 100 µg de Se/100 g de produit, la dinde, le cabillaud, le saumon, de 20 à 40 µg/100 g, le pain, le fromage, de 3 à 10 µg/100 g.
Il est recommandé de ne pas dépasser 400 µg/j, le sélénium étant toxique à haute dose en donnant la sélénose, se traduisant par la perte des cheveux, des dommages neurologiques, puis une cirrhose du foie, un œdème pulmonaire et la mort. - Agriculture et élevage : il peut être ajouté dans les engrais dans des pays dont les sols sont déficients en sélénium. Il peut être ajouté à l’alimentation animale à des teneurs de 400 à 800 µg/kg d’aliment.
Bibliographie
- T. Vulcan « Selenium : contrary stuff« , Hard Assets Investor, février 2010.
- Selenium Tellurium Development Association, Cavite Economic Zone Lot 6, Blk 1 Phase III, Rosarion, Cavite, Philippines.
- J.F. Labbé et P. Christmann, Compagnie Européenne d’Intelligence Stratégique (CEIS) (2011), « Panorama du marché 2010 du sélénium« , rapport final BRGM/RP- 60202- FR.
- « Le sélénium – éléments de criticité« , BRGM, décembre 2018.
- P. Blazy et E.A. Jdid, « Métallurgie du sélénium et du tellure », Techniques de l’Ingénieur, juin 2008.
- F. Kiling Willig, « Selenium recovery in precious metal technology« , Outotec, février 2014.