Données physico-chimiques
Données atomiques
| Numéro atomique | Masse atomique | Configuration électronique | Structure cristalline | Rayon métallique pour la coordinence 12 |
| 41 | 92,91 g.mol-1 | [Kr] 4d4 5s1 | cubique centrée de paramètre a = 0,3299 nm |
146,8 pm |
Données physiques
| Masse volumique | Dureté | Température de fusion | Température d’ébullition | Conductibilité électrique | Conductibilité thermique | Solubilité dans l’eau |
| 8,57 g.cm-3 | 6 | 2 468°C | 4 742°C | 6,93.106 S.m-1 | 53,7 W.m-1.K-1 | insoluble |
Données chimiques
| Électronégativité de Pauling | E° : Nb3+ + 3e = Nb(s) | E° : NbV + e = NbIV | E° : Nb2O5(s) + 10Haq+ + 10e = 2Nb(s) + 5H2O |
E° : NbO3+ + 2H+ + 2e = Nb3+ + H2O |
| 1,6 | -1,1 V | -0,21 V | -0,65 V | -0,34 V |
Données thermodynamiques
Niobium cristallisé
|
Niobium gazeux
|
Données industrielles
Le niobium était et est encore parfois, aux États-Unis, appelé columbium bien qu’en 1949, l’IUPAC ait définitivement adopté le nom niobium.
Matières premières
La teneur moyenne de l’écorce terrestre est de 8 ppm.
Le tantale est souvent associé au niobium dans ses gisements, les deux éléments possédant des propriétés chimiques proches. Toutefois, il existe des mines de niobium dans lesquelles le tantale n’est pas récupéré et réciproquement des mines de tantale dans lesquelles le niobium n’est pas exploité.
Minerais
Les principaux minerais sont des oxydes avec :
- La famille des pyrochlores, dont la composition évolue entre celle du pyrochlore proprement dit (Na,Ca)2Nb2O6(OH,F) et celle de la microlite (Na,Ca)2Ta2O6(OH,F). Le pyrochlore, exploité au Brésil et au Canada, est le principal minerai.
- La famille des niobio-tantalites ou colombo-tantalites, appelée coltan en Afrique Centrale, de formule : (Fe,Mn)(Nb,Ta)2O6. Appelée niobite ou colombite lorsque le minerai est plus riche en niobium et tantalite lorsque c’est l’inverse.
- La wodginite : (Ta,Nb,Sn,Mn,Fe)4O8.
Les teneurs des minerais de niobium, exprimées en Nb2O5, sont comprises entre 0,6 % au Canada et 2,5 % au Brésil, pour le gisement d’Araxá.
Le niobium est également présent dans des minerais d’étain et de titane, en substitution à l’étain dans la cassitérite et au titane dans le rutile et l’ilménite.
Les minerais de niobium renferment souvent de l’uranium et du thorium, radioactifs. Lorsque la radioactivité des produits commercialisés atteint 10 Bq/g celle-ci doit être déclarée et des précautions prises. Cette radioactivité correspond à une teneur de 0,13 % de ThO2 et 0,048 % de U3O8.
Minéralurgie
A Araxá, au Brésil, le minerai a une teneur de 2,5 % de Nb2O5 contenu dans du pyrochlore de baryum lui même avec une teneur de 4 %. Le pyrochlore de baryum s’est formé par substitution, dans le pyrochlore, des ions calcium par des ions baryum. L’exploitation a lieu à ciel ouvert, sans utilisation d’explosifs, le minerai étant naturellement friable. Après broyage à environ 100 µm, le minerai subit une séparation magnétique pour éliminer les 15 à 30 % de magnétite contenue, puis une flottation à pH compris entre 2,5 et 3,5 qui permet d’obtenir un concentré de pyrochlore.
Les concentrés de niobium commercialisés, sous forme de pyrochlore, ont une teneur de 54 à 60 % de Nb2O5.
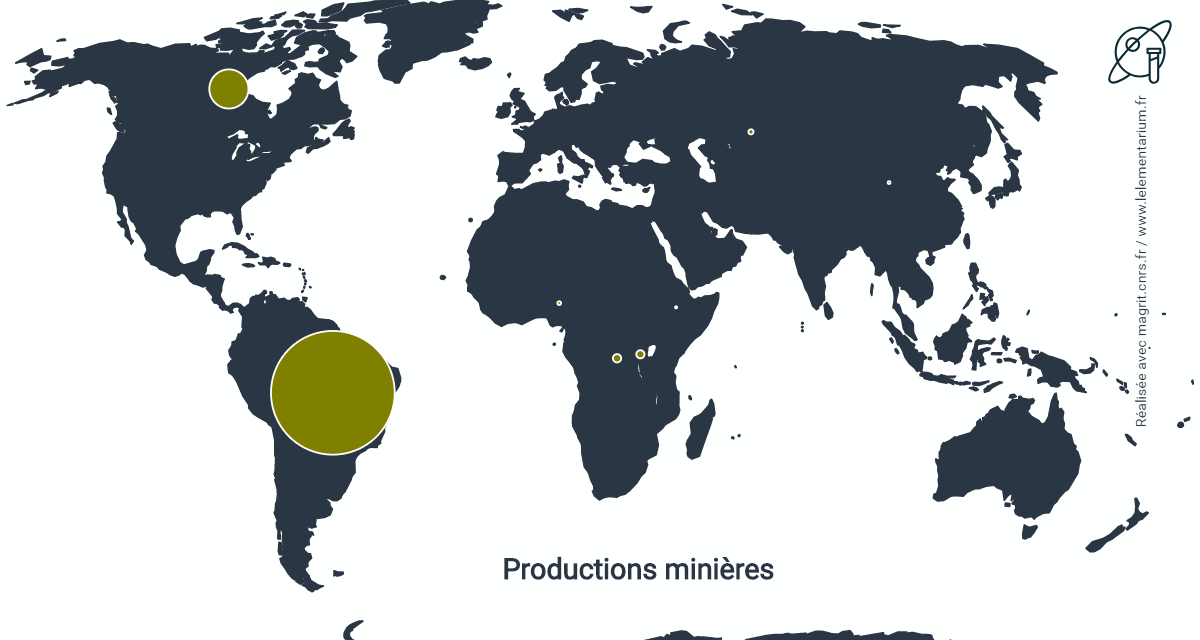
Productions minières
La production mondiale était, en 2019, de 74 000 t de niobium contenu.
| Brésil | 65 000 t | Rwanda, en 2017 | 262 t | |
| Canada | 7 600 t | Nigeria, en 2017 | 44 t | |
| R. D. du Congo, en 2017 |
570 t | Chine, en 2017 | 37 t | |
| Russie, en 2017 | 457 t | Éthiopie, en 2017 | 18 t |
Source : USGS
Les productions d’Afrique Centrale sont souvent artisanales et, en particulier, en République Démocratique du Congo contrôlées par des groupes armés. Les minerais exploités sont de la colombo-tantalite (coltan).
Le pyrochlore, principalement exploité au Brésil et au Canada, est la principale source de niobium, avec plus de 99 % du total mondial. Le reste provient de la colombite en Afrique Centrale et des laitiers issus du traitement des minerais d’étain, en Malaisie et en Thaïlande.
Producteurs
Les principaux producteurs sont :
- Le principal, et de loin, producteur mondial est la Companhia Brasileira de Metalurgia e Mineração (CBMM), qui exploite, à ciel ouvert, le gisement de pyrochlore de baryum d’Araxá dans le Minas Gerais, au Brésil. Le gisement est situé dans un cercle d’environ 4,5 km de diamètre, sur une épaisseur de 250 m. La capacité de production est de 59 000 t/an de Nb. Les réserves étaient, fin 2012, de 808 millions de t renfermant 2,5 % de Nb2O5. CBMM produit du ferroniobium, du niobium métal, des alliages de niobium, de l’oxyde et divers sels de niobium.
- Le groupe chinois China Molybdenum (CMOC), a acquis, en octobre 2016, les activités d’AngloAmerican, au Brésil, dans le niobium et les phosphates avec la mine à ciel ouvert de Boa Vista dans l’état de Goiás, le concentré produit étant transformé en ferroniobium dans l’usine d’Ouvidor. La capacité de production est de 9 000 t/an. Les réserves sont de 48,9 millions de t de minerai renfermant 0,96 % de Nb2O5 et 203,7 millions de t renfermant 0,34 % de Nb2O5 et 12,16 % de P2O5. En 2019, la production a été de 7 489 t de Nb.
- La mine de Pitinga, en Amazonie, est exploitée par Mineracão Taboca, filiale du groupe péruvien Minsur. La production de niobiotantalite est coproduite avec celle de cassitérite. Les concentrés miniers sont traités près de São Paulo pour donner d’une part de l’étain et d’autre part un ferroalliage FeNbTa renfermant 45 % de Nb et 4,2 % de Ta. En 2019, la production a été de 6 559 t d’étain, de 10 004 t de concentré renfermant 35,10 % de (Nb,Ta)2O5 et de 3 904 t de ferroalliages renfermant 58,90 % de NbTa. Les réserves prouvées et probables sont de 202,2 millions de t renfermant 0,159 % de Sn, 0,207 % de Nb2O5 et 0,027 % de Ta2O5.
- Niobec, acquise en janvier 2015 par Magris Resources exploite une mine souterraine de niobium à Saint Honoré, près de Chicoutimi, au Canada, dans la province de Québec. La mine est exploitée depuis 1976. La production est de 5 900 t/an de Nb. Les réserves sont de 416 millions de t à 0,41 % de Nb2O5. En 1994, a débuté une production de ferroniobium.
- Aux États-Unis, la société canadienne NioCorp développe le projet de la mine souterraine d’Elk Creek dans le Nebraska. Les réserves probables sont de 36,3 millions de t renfermant 0,81 % de Nb2O5, 2,86 % de TiO2 et 65,7 g/t de scandium. La production prévue est de 11 642 t/an de TiO2, 7 220 t/an de ferroniobium à 65 % de Nb et 95 t/an d’oxyde de scandium (Sc2O3).
Réserves
Les réserves mondiales étaient supérieures à 13 millions de t de niobium contenu en 2019, réparties entre le Brésil et le Canada.
| Brésil | 11 000 | Canada | 1 600 |
Source : USGS
Préparation industrielle
Les concentrés miniers sont en grande partie réduits, par pyrométallurgie, pour donner du ferroniobium.
Ferroniobium
Il contient en moyenne 65 % de niobium.
Les concentrés miniers issus des minerais de pyrochlore sont réduits par aluminothermie pour donner du ferroniobium. La réaction est la suivante :
3 Nb2O5 + Fe2O3 + 12 Al = 6 Nb + 2 Fe + 6 Al2O3
Par exemple, Niobec produit par opération 2 400 kg de ferroniobium à partir de 3 500 kg de concentré minier, 1 000 kg d’aluminium, 675 kg d’oxyde ferrique et 675 kg d’autres produits dont du nitrate de sodium. Après amorçage de la réaction, en 10 minutes, la température atteinte est de 2 250°C. 14 fusions sont réalisées par jour.
En 2018, la production mondiale de ferroniobium destinée à la production d’acier a représenté 64 929 t de niobium contenu, soit 90,8 % de la consommation de niobium dont, en 2015 sur un total de 56 200 t :
- 50 000 t au Brésil,
- 5 760 t au Canada,
- 400 t en Russie.
Ferroniobium de qualité sous vide et alliages Nb-Ni, Nb-Ti, Nb-Zr, Nb-Cu… : ces alliages destinés à des applications de hautes technologies (superalliages pour l’aéronautique, matériaux supraconducteurs, nucléaire…) demandent une purification poussée, obtenue par fusion par bombardement électronique sous vide. Ils représentaient, en 2018, 3,7 % de la production de niobium.
Niobium métal
Sa production représentait, en 2018, 1 % de l’ensemble de la production des produits de niobium. Sa teneur est de 99,9 % de Nb.
Il est produit par aluminothermie, sans ajout d’oxyde de fer. Sa purification est réalisée par fusion sous bombardement électronique, sous vide.
Oxyde de niobium
La production d’oxyde de niobium, Nb2O5, est obtenue par hydrométallurgie, à l’aide d’une lixiviation à chaud par de l’acide fluorhydrique et de l’acide sulfurique selon la réaction :
Nb2O5 + 10 HF = 4 H+ + 2 NbOF52- + 3 H2O
Le niobium et le tantale sont extraits par solvant, par exemple à l’aide de méthylisobutylcétone (MIBK) puis, le niobium est récupéré en solution aqueuse sous forme d’ion NbOF52- par lavage à l’acide sulfurique alors que le tantale reste dans la phase organique d’où il est ensuite extrait.
Un traitement par l’ammoniac donne, par précipitation, de l’hydroxyde de niobium qui, par calcination, donne l’oxyde.
2 H+ + NbOF52- + 5 NH3 + 4 H2O = Nb(OH)5 + 5 NH4+ + 5 F–
2 Nb(OH)5 = Nb2O5 + 5 H2O
L’oxyde de niobium est à la base de la production de composés chimiques du niobium. L’oxyde et les divers composés chimiques issus de l’oxyde représentaient, en 2018, 4,5 % de la production totale de produits du niobium.
Situation française
En 2019, il n’y avait pas de production.
Commerce extérieur
Les exportations étaient de 768 t pour le ferroniobium avec comme marché principal les Pays Bas à 91 % et le Canada à 6 %.
Les importations s’élevaient à 2 256 t de ferroniobium en provenance principalement à 90 % du Brésil, 4 % de Belgique, 3 % du Canada.
Utilisations
La principale utilisation du niobium est sous forme de ferroniobium, en sidérurgie.
Consommations
En 2018, la consommation mondiale de ferroniobium a été de 64 929 t, soit, en 2010, 55 g de Nb/t d’acier avec la répartition suivante :
| Chine | 25 % | Japon | 10 % | |
| Union européenne | 24 % | Reste de l’Asie | 11 % | |
| Amériques | 21 % |
En 2019, la consommation des États-Unis a été de 6 000 t de niobium.
Secteurs d’utilisation du ferroniobium
En 2016, dans la production d’aciers destinés à :
| Construction | 46 % | Pipelines | 16 % | |
| Automobiles | 23 % | Aciers inoxydables | 6 % |
Le développement ces dernières années de la consommation de niobium est lié à son utilisation dans les aciers microalliés à haute limite élastique (HSLA).
10 % des aciers utilisés dans le monde contiennent du niobium, généralement à de très faibles teneurs de 0,02 à 0,11 %. En 2017, dans le monde, en moyenne, la teneur en niobium est de 55 g de Nb/t d’acier. Dans l’Union européenne elle est de 130 g/t, en Chine, de 22 g/t. L’augmentation des propriétés mécaniques des aciers et en particulier de leur limite d’élasticité est obtenue par un affinement du grain ferritique et par une fine précipitation durcissante. Ces résultats sont obtenus à l’aide de niobium, vanadium ou titane, le niobium formant des précipités de carbures ou de carbonitrures. L’utilisation de ces aciers permet, à propriétés mécaniques identiques, de réduire l’épaisseur des aciers et donc leur poids.
Dans la construction de véhicules automobiles, 300 g de niobium dans l’acier utilisé permet de réduire le poids de 200 kg. Par ailleurs, le niobium qui augmente la résistance à la corrosion à chaud des aciers inoxydables est utilisé dans les pots d’échappement.
La construction du viaduc de Millau a utilisé de l’acier contenant 0,025 % de Nb. Cet acier à haute limite élastique a permis une diminution du poids de l’acier et du béton utilisés de 60 %.
La construction du pont de l’Øresund, entre Suède et Danemark, a utilisé de l’acier contenant 0,022 % de Nb qui a permis une réduction de poids de 15 000 t.
L’acier des pipelines transportant le gaz naturel ou le pétrole, sous pression, contient toujours du niobium, jusqu’à des teneurs de 0,11 %. La présence de niobium augmente la résistance de l’acier à la corrosion par le sulfure d’hydrogène et sa tenue aux basses températures.
Autres utilisations du niobium
Superalliages
Ils sont utilisés dans les réacteurs pour l’aéronautique et les turbines pour centrales électriques.
L’Inconel 718 contient en poids de 5,3 à 5,5 % de Nb. Il est employé, par exemple dans le réacteur CFM-56 de General Electric et Snecma qui renferme 300 kg de niobium.
Matériaux supraconducteurs
Les alliages Nb3Sn ou NbTi sont supraconducteurs à très basse température, par exemple en dessous de 18 K pour Nb3Sn et 10 K pour NbTi. Refroidis par de l’hélium liquide, à 4 K, ils sont employés pour générer des champs magnétiques intenses en IRM, en RMN ou dans des accélérateurs de particules. Par exemple, le Large Hadron Collider du CERN, à Genève, génère un champ magnétique de 8,3 teslas à l’aide de bobines magnétiques constituées par un câble comportant 36 brins torsadés eux-mêmes formés par 6 000 à 9 000 fils de 7 µm. Au total, la longueur de câble est de 7 600 km soit, pour les fils en Nb-Ti, plus de 5 fois l’aller-retour entre la terre et le soleil, avec un poids total de 500 t d’alliage.
Utilisations diverses
D’autres utilisations sont les suivantes :
- Les monocristaux de niobiate de lithium (LiNbO3), piézoélectriques, pyroélectriques et ferroélectriques, sont utilisés comme guides d’ondes.
- L’oxyde de niobium est employé, pour élaborer des verres pour applications ophtalmiques, microscopes, caméras vidéo.
- La fabrication de condensateurs à l’aide de poudre métallique.
Bibliographie
Commentaires récents